反应物过量的计算
反应物过量的计算fanyingwu guoliang de jisuan
某一反应,给出两种反应物的量,须查明这两种反应物的量是否适合反应物间的比例。若适合,可以取任意一种物质的量计算生成物的量; 若不适合,应以不足量的反应物的量来计算生成物的量。
❶ 求不适量反应物反应后所得生成物的量。例1 50mL30%的氢氧化钠溶液(密度为1.34g·mL-1)与50mL4mol·L-1硫酸溶液混合,反应后溶液呈何性?在反应后的溶液里加入5g纯度为90%的锌粒,在标准状况下能产生多少升氢气?
解 判断混合溶液的酸碱性。
50mL 30%NaOH溶液含NaOH的物质的量为
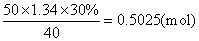
设与50mL4mol·L-1H2SO4溶液反应所需NaOH物质的量为xmol。
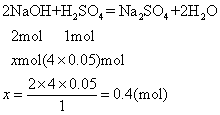
0.4<0.5025,表示氢氧化钠过量,故呈碱性。
确定锌和氢氧化钠是否适量。
5g纯度为90%的锌粒含纯锌5×90%=4.5 (g)
设剩余 NaOH的量为 0. 5025-0.4=0.1025(mol),能和yg锌反应:
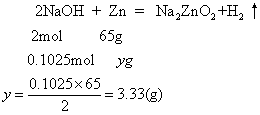
3.33 g<4.5 g,表示锌过量,按氢氧化钠计算。
确定产生氢气的体积,设为zL。
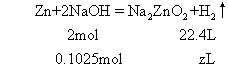
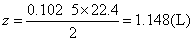
答 溶液呈碱性,标准状况下产生氢气1.148L。
❷ 过量物与生成物相互作用。
例 2 取 1 mol·L-1 AlCl3溶液20 mL加入14 mL,5mol·L-1的NaOH溶液,完全反应后可生成氢氧化铝沉淀多少克?
解 判断NaOH是否适量:
现有AlCl3物质的量为1×0.02=0.02(mol)
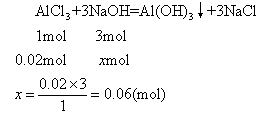
现有NaOH物质的量为5×0.014=0.07(mol)
设反应所需NaOH物质的量为xmol
0.06<0.07,表示NaOH过量。
反应后氢氧化铝生成量应为反应生成量与被溶解的量之差。剩余NaOH物质的量为0.07-0.06=0.01(mol),生成的Al(OH)3的物质的量与反应的AlCl3物质的量相同,也是0.02mol。设被溶解的量为ymol:
Al(OH)3+NaOH=NaAlO2+2H2O1 mol 1 moly mol 0.01 moly=0.01 mol
反应后生成Al(OH)3的质量为:
(0.02-0.01)×78=0.78(g)
答 完全反应后可生成氢氧化铝0.78 g
例3把一定量的Na2CO3·10H2O投入一定体积的4mol·L-1的盐酸中,结果恰好完全反应。将生成的气体通入含Ca(OH)2 1.48g的石灰水中,(假定气体没有损失)则有1.8g白色沉淀生成,试求盐酸所用的可能体积是多少?
解 设生成1.8gCaCO3需Ca(OH)2物质的量为xmol

若CO2量不足,0.018mol CO2用去盐酸为ymL
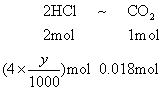
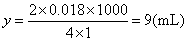
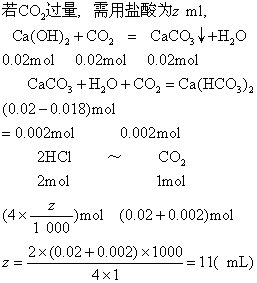
答 盐酸所用的可能体积是9mL或11mL。
☚ 求产率 多步反应的计算 ☛
- 08_158里仁篇是什么意思
- 08_159公冶長篇是什么意思
- 08_160雍也篇是什么意思
- 08_161述而篇是什么意思
- 08_162泰伯篇是什么意思
- 08_163子罕篇是什么意思
- 08_164鄉黨篇是什么意思
- 08_165先進篇是什么意思
- 08_166顔淵篇是什么意思
- 08_167子路篇是什么意思
- 08_168憲問篇是什么意思
- 08_169衛靈公篇是什么意思
- 08_170季氏篇是什么意思
- 08_171陽貨篇是什么意思
- 08_172微子篇是什么意思
- 08_173子張篇是什么意思
- 08_174堯曰篇是什么意思
- 08_175論語次序是什么意思
- 08_176論語雜著是什么意思
- 08_177論語劄疑是什么意思
- 08_178論語講義是什么意思
- 08_179論語劄録是什么意思
- 08_180論語講義是什么意思
- 08_181論語問答是什么意思
- 08_182論語答問是什么意思
- 08_183論語注釋是什么意思
- 08_184論語序説是什么意思
- 08_185學而第一是什么意思
- 08_186為政第二是什么意思
- 08_187八佾第三是什么意思
- 08_188里仁第四是什么意思
- 08_189公冶長第五是什么意思
- 08_190雍也第六是什么意思
- 08_191述而第七是什么意思
- 08_192泰伯第八是什么意思
- 08_193子罕第九是什么意思
- 08_194鄉黨第十是什么意思
- 08_195先進第十一是什么意思
- 08_196顔淵第十二是什么意思
- 08_197子路第十三是什么意思
- 08_198憲問第十四是什么意思
- 08_199衛靈公第十五是什么意思
- 08_200季氏第十六是什么意思
- 08_201陽貨第十七是什么意思
- 08_202微子第十八是什么意思
- 08_203子張第十九是什么意思
- 08_204堯曰第二十是什么意思
- 08376是什么意思
- 08574是什么意思
- 08論語卷五是什么意思
- 09_002韓國經學資料集成論語第十六册是什么意思
- 09_003論語古今注疏講義合纂 上是什么意思
- 09_004目録是什么意思
- 09_005論語序説是什么意思
- 09_006史記仲尼弟子列傳是什么意思
- 09_007學而第一是什么意思
- 09_008學而第一 之下是什么意思
- 09_009為政第二 之上是什么意思
- 09_010為政第二 之下是什么意思
- 09_011八佾第三 上是什么意思