生物制片技术preparation of biologicalslides
制备用于光学显微镜观察生物样品的技术。根据制片的步骤分为切片法与非切片法。切片法有石蜡切片、冰冻切片、火棉胶切片、碳蜡切片和塑料切片等,还有不需使用专门切片机的徒手切片; 非切片法包括装片、磨片、涂片、沾片、压片、舖片和浸渍分离片等。所有这些制片的原则与要求基本一致:❶必须尽可能保持动植物器官、组织和细胞原有的形态结构;
❷必须有利于在光镜下观察;
❸如系制备永久性玻片,标本则必须注意脱水、防腐、封固。
切片法
石蜡切片法 将生物样品包埋于石蜡内而后进行切片的方法。是动植物组织的一种常规切片法。由于石蜡仅溶于有机溶剂,故材料在包埋前必须充分脱水,再用石蜡溶剂取代组织中的脱水剂,然后浸泡在熔化的石蜡内,使细胞内外浸透石蜡,冷却凝固后即可进行切片。以动物组织为例,简要说明苏木精-伊红染色的常规石蜡制片步骤。
取材与固定 根据不同要求将动物杀死后立即取材,组织块厚度以2mm较为理想。“固定”是指以化学试剂处理样品使其迅速阻止细胞发生死后变化,自溶或腐败,并使其尽可能保持生活状态时的形态结构和有利于以后的制片步骤。常用的固定剂有酒精、甲醛、氯化汞、醋酸、苦味酸、重铬酸钾、铬酸、锇酸、丙酮等以及根据各种配方配制的上述药品混合固定剂,如波恩氏液、卡罗氏液、辛克氏液等。组织块取好后必须立即投入10~15倍以上的固定剂中进行固定,固定时间一般为12~24小时。固定完成后应用水或其他适当溶液将多余的固定剂洗去。
脱水与透明 通常以酒精和二甲苯分别作为脱水剂和透明剂,因为用低浓度到高浓度的酒精(30%—→50%—→70%—→85%—→95%—→无水酒精) 处理组织块,可使细胞内外的水分完全被酒精取代,而酒精又能与二甲苯以任何比例混合,组织块浸置于二甲苯一定时间后,其内含有的酒精被二甲苯取代,此时组织块呈现透明状态,“透明”之称即由此而来。在某些场合下,可用丙酮作为脱水剂,苯、甲苯、氯仿和香柏油等作为透明剂。此外,正丁醇、松脂醇和二氧陆圜等兼具有脱水剂和透明剂的作用,组织块用此类试剂处理后,无需二甲苯作中间过渡即可直接透蜡。
透蜡与包埋 将经处理呈透明状态的组织块置于52~56℃的熔化石蜡中,持续一定时间后,组织块内含有的二甲苯完全被石蜡所取代,此即透蜡过程,透蜡时间通常约2~3小时。组织块浸透蜡后方可包埋,最简单的包埋方法是将浸透蜡的组织块连同适量熔化的石蜡置于铜包埋框或手叠的纸盒中,然后将其放入冷水,使其迅速冷却凝固成块,包埋时须注意放置组织块的方位,切勿使组织块周围留存气泡。
切片与贴片 切片前应将组织块周围过多的石蜡切去,并将未来的切面修切成四方形或长方形,特别是上下边要平行,以免将来切出的蜡带弯曲。一般使用旋转式切片机,切片厚度约3~5μm,切出的石蜡薄片略有皱纹,可将其铺于35~45℃的温水,利用水的张力和热度使蜡片伸展平整地漂浮于水面,然后用涂有蛋白甘油粘贴剂的或者非常洁净的载玻片捞取蜡片,调整其在载玻片上的位置后烘干,蜡片即牢固地贴附于载玻片上。有时还可滴少许水在涂有蛋白甘油的载玻片上,再将蜡片放在水面,直接在35~45℃的展片台上贴片。
染色 可在组织块尚未脱水前进行块染,也可在切片后进行片染。块染较难掌握,但可节约药品和时间,故常在制备大量切片标本时采用。片染是常规染色方法,染色前必须先用二甲苯脱蜡,使载玻片上只剩下组织薄片,细胞内外的石蜡也全被二甲苯置换,再用高浓度到低浓度的各级酒精处理使其复水,然后进行染色。苏木精是一种碱性染料,可使细胞核着蓝色,一般用水溶液。伊红是一种酸性染料,可使细胞质着曙红色,通常用酒精溶液。
脱水、透明与封固 切片经染色后,须再次用酒精脱水和用二甲苯透明,使组织切片内的水被酒精置换,酒精又被二甲苯置换,所以组织切片透明后,即可滴上适量树胶,加盖玻片封固。
植物组织石蜡切片的步骤与动物组织基本相同,但由于植物表面往往被覆有厚薄不一的角质层或木栓层,植物细胞都有细胞壁,所以药剂渗透速度一般较慢,在制片过程中,固定、脱水、透明与透蜡所需时间都比较长,特别是在透蜡时,一般不是将透明的组织块直接转移到熔化的石蜡,而是采取不同的方法将石蜡慢慢熔在浸有组织块的二甲苯中,使其浓度逐渐增高,渗入植物组织块的石蜡也随之逐渐增多,直到容器中二甲苯与石蜡约各半时,再将组织块转移至熔化的纯蜡中,使组织块内二甲苯全部被石蜡置换,其间可换石蜡1~2次。其次,植物石蜡法制片中常用的染色方法为番红-固绿染色法、苏木精单染或与固绿一起作对比染色。番红是一种碱性染料,可使木质化的细胞壁和细胞核着红色,常用50~70%酒精配制成1%溶液,在石蜡切片脱蜡,从高浓度酒精到70%酒精后进行染色。固绿是一种酸性染料,可使具纤维素的细胞壁及细胞质着绿色,常用95%酒精或丁香油配制成0.5%溶液,因此切片用番红染色后需经70%和85%酒精脱水,如固绿系用丁香油配制则还须经95%和无水酒精脱水,才可用固绿进行复染,最后经继续脱水、透明和封固,即成永久性玻片标本。
冰冻切片法 使组织块冻结而后进行切片的制片方法。新鲜的或经过固定的组织块无需经过脱水、透明和包埋等一系列处理步骤,即可设法使其冻结并切片。使组织块冰结的方法不一,或将液态CO2通入专用的CO2冰冻切片机,使其直接从中空的标本台喷射而出,利用液态CO2气化时大量吸热而使组织块冻结; 或在旋转式切片机上,安装半导体致冷器,通过整流器调节电流强度,从而控制组织块和切片刀的致冷温度,当组织块冻结达到一定的硬度时即可进行切片,切片的厚度则通过切片机上的微调装置调节;另外,还有一种低温恒冷箱,内装冷冻样品台和切片机,恒冷箱、冷冻样品台和切片刀的温度均可根据需要进行调节,一般恒冷箱维持在-5℃,冷冻样品台维持在-15~-20℃,可使组织块在数秒钟内冻结,切片刀则维持在-15~-35℃,但后两者必须根据不同的组织确定其合适的温度,切片刀的外侧安装有抗卷板,可防止切片卷曲、起皱或破损。三种冰冻切片方法中,以在低温恒冷箱内切片最为方便,受室温的影响也最小。冰冻切片的厚度一般为8~15μm,可直接贴附在载玻片上,也可用毛笔将其转移到水中,然后捞取贴附在涂有蛋白甘油的载玻片上,有时还须用明胶或火棉胶溶液加固,避免在以后的操作过程中脱落。冰冻切片染色后可直接封固在甘油明胶中,也可按常规脱水,透明与封固。
火棉胶切片法 用火棉胶包埋而后进行切片的制片方法。取材、固定和脱水等步骤均与石蜡法相同,也可进行块染,但由于用火棉胶包埋的组织块一般都比较大,以上各步骤所需时间都较长,特别是高浓度和无水酒精处理时,往往各需要12~24小时。脱过水的组织块需先用无水酒精和乙醚的等分液过渡,然后转移到用无水酒精和乙醚等分液配制的2%、4%、8%、10%和12%的火棉胶溶液,每一级火棉胶溶液处理时间的长短取决于组织块的大小和厚薄。火棉胶包埋时是将组织块连同适量12%火棉胶溶液置于有木托的纸盒中,静置片刻使火棉胶表层稍微凝固后,再用玻璃罩连同一盛有氯仿的培养皿一起罩住,火棉胶因接触氯仿气体而逐渐硬化,然后将火棉胶块连同木托暂时保存于70%酒精中。木托的作用是切片时用来夹在切片机的样品固定器上。火棉胶切片多用滑动切片机,切片厚度一般为10~12μm,厚者可达100μm以上。切片时须随时将70%酒精涂在火棉胶块和切片刀上,使其保持一定的湿润度和硬度。切出的火棉胶薄片可先保存在70%酒精中,以后再贴附在涂有蛋白甘油的载玻片上,或直接用游离的火棉胶薄片进行染色和其他步骤,最后再封固在载玻片上。有些镀银的火棉胶切片封藏时用较浓、较多的树胶或香柏油,不加盖玻片。
碳蜡切片法 用碳蜡包埋组织块而后切片的制片方法。用于包埋的碳蜡有两种,其分子量分别为1 500和4 000;熔点依次为35~40℃和50~55℃。气温过高时则需加入少许分子量更高的碳蜡。经过固定的组织块充分洗涤后即可进行渗透碳蜡。先将其浸置于分子量为1 500的熔化碳蜡,而后转移到分子量为4 000的熔化碳蜡,全过程需时约1~3小时。包埋工具和方法与石蜡法相同,但不能用冷水加速其凝固过程,可静置于室温中使其自然冷却凝固。如需长期保存碳蜡块,应将其存放于干燥器内。碳蜡块的切片方法大体与石蜡块相同,切出的碳蜡薄片可贴附于涂有蛋白甘油的载玻片上,但由于在贴片过程中需用水,碳蜡被熔解,最后载玻片上只留下组织薄片。其他步骤也与石蜡法相同。
塑料切片法 用塑料包埋组织块进行切片的制片方法。常用塑料包埋剂有乙二醇甲基丙烯酯(GMA)和环氧树脂,用前者制备的切片可用来做各种组织化学反应、荧光和免疫荧光等试验,但不能用于电镜观察; 后者正相反,其薄切片不能用于组织化学方法,但可用来与邻近的超薄切片结合起来观察。GMA是一种水溶性塑料包埋剂,用前需提纯和加入增塑剂和加速剂,有多种配方。固定组织块须选用非凝固性固定剂,如戊二醛、甲醛和锇酸等。经充分洗涤和脱水后,在0~4℃渗透GMA,需时约2~30天,取决于组织块的种类、大小和厚薄。然后将组织块转移至胶囊或铝纸杯中,在70℃温箱聚合12小时,或在较低温度下聚合更长时间,如做酶组织化学反应则须用紫外光照射使其凝固。聚合后的GMA包埋块很硬,且不会受温度影响而变软,但绝不能沾水。GMA包埋块经修整即可在普通旋转式切片机上用玻璃刀切成1~2μm薄片,然后用镊子将其转移到载玻片上水滴的水面上使其展开,并在70℃展片台上烘干,此时载玻片上的GMA已被熔去,仅留下组织薄片,经染色和其他处理,即可在光镜下进行观察或制成永久性玻片标本。环氧树脂包埋方法与制备供电镜观察的超薄切片相同,切片则与GMA包埋块相同。
徒手切片法 用手持刀将新鲜材料切成薄片的制片方法,在植物学研究中使用比较广泛。徒手切片的材料不能过大,截面一般不超过3~5mm2。过于柔嫩的植物材料(如叶片)难以直接用手拿住切片时,可夹在接骨木、向日葵茎的髓或胡萝卜中进行切削。切成的组织薄片须随时置于水中,然后挑选平整、厚薄适宜者按常规制成临时或永久性玻片标本。
非切片法 将动植物材料压碎、撕破、磨薄或涂成薄层等手段,甚至直接将体积较小的动植物整体或其部分结构,按照制片的原则与要求制成临时或永久性玻片标本的方法。
装片法 主要用于微小体的动植物整体或局部结构,以及早期胚胎制片。例如,团藻、水绵、孢子囊、原叶体以及某些高等植物的表皮、花粉粒等; 草履虫、水螅、红蜘蛛、昆虫口器、鱼类鳞片以及蛙胚、鸡胚和猪胚等。这类材料经过固定、染色、脱水和透明均可制成永久性玻片标本,只是由于材料不同,使用的脱水剂、透明剂和封固剂等也不完全相同。
磨片法 主要用于脊椎动物的齿、角和骨胳,棘皮动物的骨板、软体动物的介壳、珊瑚虫的外骨胳、植物的坚硬组织,如山核桃、胡桃和桃的果皮,以及动植物化石制片。磨片前需先将这类材料锯成1~2mm薄片,然后分别用粗磨石、细磨石和毛玻璃等将其磨平磨薄,直到在光镜下能观察到其细微结构为止,经染色或不经染色,即可制成永久性玻片标本。
涂片法 主要用于细菌、小型浮游藻类、血液、骨髓以及脊髓的灰质。这类材料如为液体状态,可用载玻片蘸取少许样品置于另一清洁载玻片的一端,并将其推向载玻片的另一端,使成薄薄一层。否则须用解剖刀轻轻将样品压住,从载玻片的一端涂抹至另一端。涂片干燥后,可以选用不同的固定剂和染色剂进行固定和染色,并制成临时或永久性玻片标本。处理样品时,如果仅仅将其在清洁的载玻片上印贴一下,使其细胞被印贴在载玻片上,然后制成玻片标本,这种制片方法则称为印片或蘸片法,例如用小白鼠膀胱粘膜制备观察细胞无丝分裂的玻片标本即常采用此法。
压片法 常用于果蝇或摇蚊幼虫唾液腺制片,观察其多线染色体形态,也常用于植物的根尖、茎端或花药制片,观察其有丝分裂或减数分裂中的染色体,并可计数。此外还可用此法制备观察其他结构的玻片标本,如横纹肌上的运动终板和肌梭。压片时先在载玻片上滴少许液体以避免压碎的细胞粘连在一起,所用液体因材料性质而异。然后将材料置于液体内,加盖玻片,并轻轻压迫盖玻片,使材料破碎。这些材料通常已事先经过固定和染色,有些还经过特殊处理,使染色体缩短变粗,或使细胞壁之间的中胶层水解,有利于细胞分属。但也有直接用新鲜材料压片者,在这种情况下,载玻片所滴液体多兼有固定和染色的作用,此时即可供临时观察。如需短期保存,可在盖玻片四周封蜡。若要制成永久性玻片标本则须将盖玻片与载玻片分离,然后才能将它们分别按常规制成永久性玻片标本。
铺片法 常用于皮下疏松结缔组织、肠系膜、心包膜和羊膜制片,植物叶片的表皮也常用此法制片。若取皮下疏松结缔组织和肠系膜,观察其内巨噬细胞的吞噬作用,动物往往事先注射过活体染料或墨汁,将动物杀死取出皮下疏松结缔组织后须随即用解剖针将其展开,平铺在载玻片上,肠系膜则可先在载玻片上固定,然后剪成小块贴附在涂有蛋白甘油的载玻片上,也可用整块肠系膜操作,直到临封固前才将其剪成小块,平铺在载玻片上。其他制片步骤均按常规处理,只是染色方法应根据材料和观察目的而定。
浸渍分离法 用浸渍分离液处理组织,使其单个细胞分离而后制片的方法。新鲜的或经过固定和染色的组织块用浸渍分离液处理一定时间后逐渐变软,结构变得比较疏松,细胞与细胞之间的物质也逐渐溶解。此时予以振荡,或用注射器反复抽吸冲击,单个细胞可各自分离,显现出其立体形态。有时单靠振荡和抽吸还不足以使细胞解离,必须用解剖针顺着一定方向将材料逐步梳理撕细。然后根据材料的性质和观察目的制成临时或永久性玻片标本。浸渍分离液配方甚多,其中常用的药品有铬酸、盐酸、硝酸、苦味酸、酒精和氢氧化钾等。如不要求观察单个细胞的形态,只是了解器官组织的某些特定结构,则可选用解离能力较弱的浸渍分离液,或缩短浸渍时间,振荡冲击也应适当减弱,必要时可在解剖镜下借助于解剖器将其分离出来。动物的上皮细胞、神经细胞、骨胳肌和平滑肌纤维、神经纤维以及细尿管等,植物的叶肉组织和木质部的组织均常用浸渍分离法制片。
染色法
生物染料 是具有鲜艳色彩、对动植物组织有亲和力的有机化合物,其结构复杂,种类繁多,少数为天然染料,大部分为合成染料,因其均可由煤焦油的一种或数种物质制成,故称煤焦油染料,它们是芳香族有机化合物,主要是苯的衍生物。
性质 染料的主要成分为色原,由一个或数个芳香环和一个或数个发色团的原子群组成,由于具有发色团,所以是有色的有机化合物,发色团的种类不多,主要有亚硝基(-NO2 )、硝基(-NO3)、偶氮基(-N=N-)、羰基(>C=O)和烯基(>C=C<)等。但单有色原仍不能成为染料,因为它对动植物组织没有亲和力,不能直接染色。所以还必须有能促使其产生亲和力的辅助原子团,称助色团,它们是一些酸碱性基团,酸性 有羟基(-OH)、羧基(COO-)和磺酸基(-SO3H)等;碱性基团有氨基(-NH2)、甲氨基(-NHCH3)和二甲氨基〔-N(CH3)2〕等。助色团的作用是使有色物质具有盐类性质,在溶液中可电离成为带电荷的离子,从而具有与动植物组织中相应成分结合的能力。现以三硝基苯和三硝基苯酚(或称苦味酸) 为例,说明发色团和助色团在染料中的作用。三硝基苯有三个硝基作为发色团,故为黄色化合物,但由于缺乏助色团,因而无染色能力。如以羟基置换三硝基苯的一个氢原子,生成的三硝基苯酚由于既有硝基作为发色团,又有羟基作为助色团,所以具有染色能力,可作为一种黄色染料使用。由此可见,染料的颜色由发色团产生,而染色能力则有赖于助色团。有时助色团虽可使染料的颜色进一步加深,但不可能改变染料的颜色。
分类 可根据染料的来源、染色的对象、染料的溶解性能、发色团的种类以及助色团的性质分别进行分类。这里着重讨论酸性染料与碱性染料。所谓酸性染料和碱性染料并非指染液中氢离子浓度,而是指染料的助色团是酸性基团还是碱性基团。染料本身则大都是盐类,只有极少数为游离的酸或碱。酸性染料通常为钠盐,少数为钾、钙或铵盐,含有酸性助色团,电离后能放出氢离子,使染料成为阴离子,常用的有伊红、固绿、苯胺和橘红G等,它们都是细胞染色剂。碱性染料通常为氯化物,或者是硫酸盐或醋酸盐,含有碱性助色团,遇水或加酸后,其三价氨转变为五价氨,放出羟基,染料离解成为阳离子,常用的有番红、甲基绿、碱性品红、次甲蓝等,天然染料中的苏木精也是一种常用的碱性染料,它们都是细胞核染色剂。
染色原理 从物理学角度考虑,主要是组织和细胞能吸收、溶解或吸附这些染料而被着色,或者染料通过毛细管作用和渗透作用进入组织和细胞后,由于其内含有酸类、碱类或其他化学物质而发生沉淀,从而使组织和细胞着上色。从化学角度考虑,染料与组织和细胞之间是化学性结合,酸性染料可与组织和细胞中的碱性成分结合;碱性染料则可与酸性成分结合。但实际情况远为复杂,因为蛋白质是两性物质,在等电点时能形成两性离子,溶液的pH值小于该蛋白质的等电点时,蛋白质带正电,可被酸性染料着色;反之,蛋白质带负电,易被碱性染料着色。
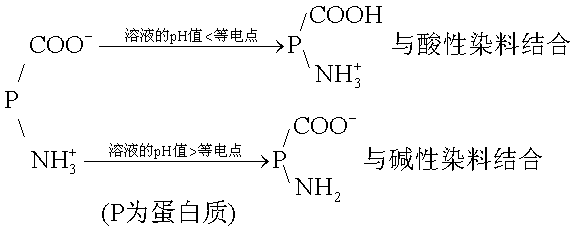
所以调节染液的pH至关重要,在近似中性的染液中,细胞核通常被碱性染料着色,称为嗜碱性,而细胞质则被酸性染料着色,称为嗜酸性。
金属染料与金属镀染 金属并非染料,由于在生物制片过程中,常用某些可溶性重金属盐的溶液处理组织和细胞,可以使某些用一般染色方法不能够着色的结构和成分显示出来,故常将这些金属称为金属染料,这一“染色”过程称为金属镀染,常用的金属染料有氯化金、硝酸银和锇酸(四氧化锇),其溶液本身一般无色。镀染时是将组织块或组织切片浸于金属染料溶液中,经过一定时间后,再用还原剂处理,使吸附在组织某些结构上的重金属盐生成不溶性金属或金属的化合物,沉积在这些结构的表面而显出黑褐色。因此在金属镀染过程中,金属染料并未与组织和细胞发生化学性结合。
生物制片技术preparation of biological slides
制备光学显微镜观察的生物样品的制作技术。按制片步骤可分为切片法和非切片法。切片法有石蜡切片、冰冻切片、火棉胶切片、碳蜡切片和塑料切片等,另还有不需用器械的徒手切片;非切片法包括装片、磨片、涂片、沾片、压片、铺片和浸渍分离片等。制片原则和要求:
❶尽可能保持动植物器官、组织和细胞的原有形态结构;
❷便于在光学显微镜下观察;
❸作为永久性玻片,标本必需脱水、防腐和封固;
❹进行染色。
- 作家的童年是什么意思
- 作家的童年丛书是什么意思
- 作家童年散文百篇是什么意思
- 作家职业道德是什么意思
- 作家节是什么意思
- 作家论是什么意思
- 作家论集是什么意思
- 作家谈创作是什么意思
- 作家谈创作丛书是什么意思
- 作家谈高、初中语文课文是什么意思
- 作家风格是什么意思
- 作家风格是什么意思
- 作对是什么意思
- 作小楼双树间诗轴是什么意思
- 作州兵是什么意思
- 作废是什么意思
- 作怪是什么意思
- 作怪是什么意思
- 作怪 作祟是什么意思
- 作恶多端是什么意思
- 作情解是什么意思
- 作成拒付通知的时间是什么意思
- 作战是什么意思
- 作战原则是什么意思
- 作战后勤保障是什么意思
- 作战心理是什么意思
- 作战手段和方法是什么意思
- 作战模型是什么意思
- 作战模拟的研究及其应用是什么意思
- 作战系统工程导论是什么意思
- 作战费是什么意思
- 作揖主义是什么意思
- 作数日恶是什么意思
- 作文借鉴辞典是什么意思
- 作文基础训练集——想想是什么意思
- 作文害道是什么意思
- 作文心理是什么意思
- 作文心理是什么意思
- 作文指导讲话是什么意思
- 作文描写辞典是什么意思
- 作文描写辞典是什么意思
- 作文教学简论是什么意思
- 作文法大辞典是什么意思
- 作文测评理论与实践是什么意思
- 作文用词手册是什么意思
- 作文研究是什么意思
- 作文自出机杼者极难,而古赋为尤难是什么意思
- 作文讲评五十例是什么意思
- 作文词典是什么意思
- 作文词典是什么意思
- 作新书院记是什么意思
- 作新村之战是什么意思
- 作明轨范师是什么意思
- 作曲三难是什么意思
- 作曲家格林卡是什么意思
- 作曲家莫索尔斯基是什么意思
- 作曲家论音乐是什么意思
- 作曲技法是什么意思
- 作杏花看是什么意思
- 作歌是什么意思