1.基本关系式:
❶ )pH=—lg{c(H+)}
❷ c(H+)=10—pHmol/L
❸ 在任何水溶液中,由水电离产生的c(H+)与c(OH—)总是相等的:c水(H+)=c水(OH—)
❹ 常温(25℃)时:Kω=c(H+)·c(OH—)=1×10—14
2.强酸与弱酸、强碱与弱碱溶液加水稀释后pH的计算:
a.强酸与弱酸加水均稀释10n倍时:
强酸:pH稀=pH原+n
弱酸:pH稀
b.强碱与弱碱溶液加水均稀释10n时:
强碱:pH稀=pH原—n
弱碱:pH稀>pH原—n
注 酸溶液无论如何稀释,溶液的pH都不会大于7;碱溶液无论如何稀释,溶液的pH都不会小于7.当它们无限稀释时,溶液的pH只能无限接近于7,因此时需考虑水的电离.
3.混合溶液的pH计算
❶ 两强酸混合
先求:
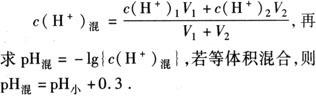
❷ 两强碱混合:

❸ 强酸与强碱混合:
a.若恰好中和,混合液显中性,pH=7.

- 吉特是什么意思
- 吉特克森人是什么意思
- 吉特古尔之战是什么意思
- 吉特巴是什么意思
- 吉特巴舞是什么意思
- 吉特巴舞(美)是什么意思
- 吉狄新和是什么意思
- 吉狄马加是什么意思
- 吉狄马加 一个彝人的梦想是什么意思
- 吉猛是什么意思
- 吉玉是什么意思
- 吉珠是什么意思
- 吉珠沟是什么意思
- 吉珥哈列设是什么意思
- 吉瑞是什么意思
- 吉瑞法是什么意思
- 吉瑞祥嘉庆,今也宿於何处。是什么意思
- 吉生是什么意思
- 吉甫是什么意思
- (吉甫作诵)穆如清风。是什么意思
- 吉甫清风是什么意思
- 吉甫裁诗是什么意思
- 吉甫逐儿是什么意思
- 吉甫颂是什么意思
- 吉田是什么意思
- 吉田书简是什么意思
- 吉田松阴是什么意思
- 吉田茂是什么意思
- 吉甲是什么意思
- 吉留是什么意思
- 吉登是什么意思
- 吉登斯,安东尼是什么意思
- 吉白是什么意思
- 吉皇是什么意思
- 吉皎是什么意思
- 吉益东洞是什么意思
- 吉益东洞古方医学全集是什么意思
- 吉相是什么意思
- 吉石是什么意思
- 吉石盦丛书是什么意思
- 吉礼是什么意思
- 吉祝是什么意思
- 吉神是什么意思
- 吉祥是什么意思
- 吉祥不止是什么意思
- 吉祥与妖异是什么意思
- 吉祥丸是什么意思
- 吉祥之云气是什么意思
- 吉祥之星高高照临是什么意思
- 吉祥亨通是什么意思
- 吉祥兆是什么意思
- 吉祥兴盛是什么意思
- 吉祥包是什么意思
- 吉祥号是什么意思
- 吉祥和不吉祥是什么意思
- 吉祥和睦是什么意思
- 吉祥善事是什么意思
- 吉祥喜庆是什么意思
- 吉祥喜庆的事有很多是什么意思
- 吉祥图案是什么意思