自由能-氧化态图
自由能-氧化态图ziyouneng-yanghuataitu
自由能变与氧化态的关系图。由于标准自由能变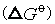 与标准电极电势
与标准电极电势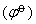 存在这样关系:
存在这样关系: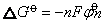 为电对得失电子数,也可视为氧化态,F为法拉第常数)。若
为电对得失电子数,也可视为氧化态,F为法拉第常数)。若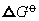 的单位为电子伏,则此式可变为
的单位为电子伏,则此式可变为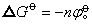 。因而对某种元素的各氧化态的电对,以其
。因而对某种元素的各氧化态的电对,以其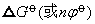 为纵坐标,n为横坐标作图,就可得到自由能-氧化态图。此图直观而简明地表示出不同氧化态物质氧化还原反应自发进行的方向和趋势的大小; 标示出自由能与标准电极电势的数值及其关系; 表示出可自发歧化的氧化态。自由能-氧化态图简称氧化态图,由于它是A.A.费罗斯特于1950年首先提出的,也称费罗斯特图。下面是第一过渡系元素的自由能-氧化态图(1mol·L-1H+)。
为纵坐标,n为横坐标作图,就可得到自由能-氧化态图。此图直观而简明地表示出不同氧化态物质氧化还原反应自发进行的方向和趋势的大小; 标示出自由能与标准电极电势的数值及其关系; 表示出可自发歧化的氧化态。自由能-氧化态图简称氧化态图,由于它是A.A.费罗斯特于1950年首先提出的,也称费罗斯特图。下面是第一过渡系元素的自由能-氧化态图(1mol·L-1H+)。
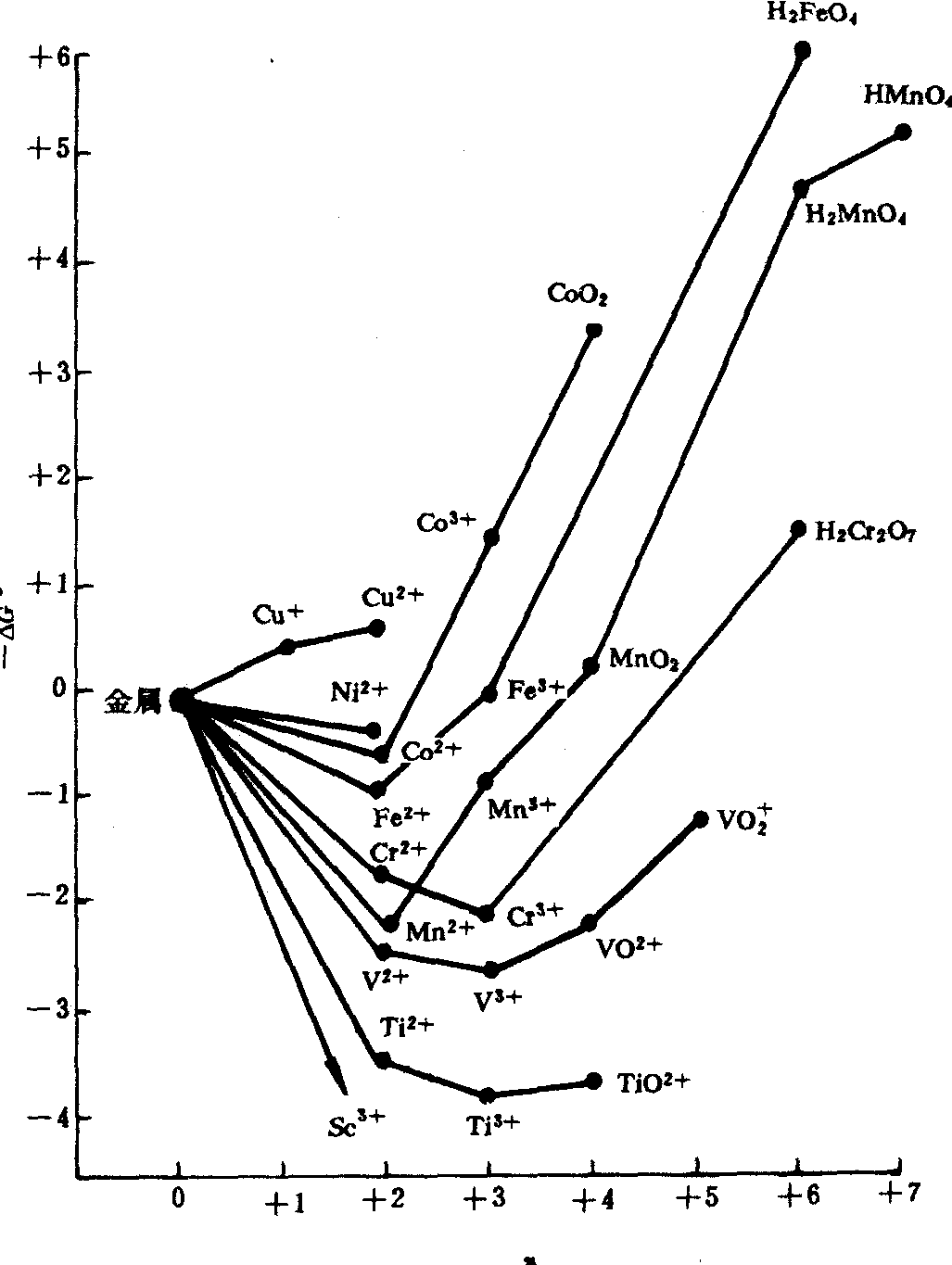
第一过渡系元素自由能一氧化态图
由上图可知:
❶ 相邻两氧化态连线的斜率代表由该两氧化态物种构成电对的标准电极电势,斜率越大,其氧化型物质越不稳定,是越强的氧化剂; 若斜率越小或为负值,其还原型物质越易被氧化,是越强的还原剂。
❷ 从处于较高位置的状态向较低位置的状态变化过程是
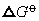 值减小的过程,且<0是自发过程。所以处于曲线最低点的物种是最稳定的。
值减小的过程,且<0是自发过程。所以处于曲线最低点的物种是最稳定的。❸某个中间氧化态的物种若位于左右两氧化态物种连线的上方,则不稳定,易发生歧化反应,生成两相邻物种。相反,若位于连线的下方,则比较稳定。
☚ 电势-pH图 有效原子序数规则 ☛
- 客观不能是什么意思
- 客观世界是什么意思
- 客观主义是什么意思
- 客观主义历史学派之父是什么意思
- 客观主义法学世界观和形式主义法学世界观是什么意思
- 客观主义者是什么意思
- 客观举证责任是什么意思
- 客观之心是什么意思
- 客观之诗人是什么意思
- 客观事物是什么意思
- 客观事物的个别特征在头脑中引起的直接反应是什么意思
- 客观体征是什么意思
- 客观关联物是什么意思
- 客观再现是什么意思
- 客观冷静地对待处理问题是什么意思
- 客观分析是什么意思
- 客观制度条约是什么意思
- 客观制约估价是什么意思
- 客观剪辑是什么意思
- 客观副词是什么意思
- 客观原则是什么意思
- 客观听力检查法是什么意思
- 客观唯心主义是什么意思
- 客观商行为是什么意思
- 客观地位是什么意思
- 客观均衡条件是什么意思
- 客观域外刑事管辖权是什么意思
- 客观存在是什么意思
- 客观存在的一切物体和现象是什么意思
- 客观实在是什么意思
- 客观实际是什么意思
- 客观对应物是什么意思
- 客观式叙述是什么意思
- 客观式报道是什么意思
- 客观归罪是什么意思
- 客观心理学是什么意思
- 客观态度是什么意思
- 客观性是什么意思
- 客观性与实践性原则是什么意思
- 客观性原则是什么意思
- 客观性和主观能动性相结合的原则是什么意思
- 客观性失恋是什么意思
- 客观性测验和论文式测验是什么意思
- 客观性焦虑是什么意思
- 客观性耳鸣是什么意思
- 客观性试题是什么意思
- 客观意义上的继承权是什么意思
- 客观批评是什么意思
- 客观报导能力是什么意思
- 客观报道是什么意思
- 客观指标是什么意思
- 客观描绘人物心理是什么意思
- 客观权利是什么意思
- 客观条件是什么意思
- 客观条约制度是什么意思
- 客观标志说是什么意思
- 客观概率是什么意思
- 客观法是什么意思
- 客观测验是什么意思
- 客观焦虑是什么意思