同位素tóng wèi sù
同一元素中质子数相同、中子数不同的各种原子互为同位素。1934年《自然科学辞典》:“【同位素】,(化)Isotope。”1935年《科学》第十九卷第四期:“他们很正确的推论说,一定有氢的同位素(isotope)存在。”同位素曾经也称“同位元素”。
同位素isotope
在元素周期表中处于同一位置,即质子数相同而中子数不同的一组核素。如1H、2H和3H互为同位素,30P、31P和32P也互为同位素。但3H和32P并非为同位素,而分别是一种核素(具特定核特征即质子数、质量数和核能态的一类原子)。核素分两类(同位素也相应分两类):一类为稳定性核素、其核不随时间发生可测知的变化,例如,12C、14N和31P等,均天然存在;另一类为放射性核素。其核会自发改变结构,放出带电或不带电的粒子(也称射线),转变成另一种原子核,例如,14C、32P及45Ca等。目前,已知的核素达1800多种。其中放射性核素约1500多种,极大部分为人工制备(主要是反应堆)。农业上应用核素为50~60种,农业化学研究中常应用的稳定性核素为15N;放射性核素有3H、14C、32P、45Ca、65Zn及86Rb等。通常,认为一种元素的同位素具有相同的物理、化学和生物学性质,只是核物理性质不同,这是农业研究中同位素应用的依据。但实际上,由于同位素间质量上的差异,会在性质上产生一定的差异,即同位素效应,不过这种效应除对质量差异较大的低原子序数同位素外,都很小,常在实验误差范围内。
同位素isotope
质子数(Z)相同、原子质量数(A)不同、化学性质基本相似、在元素周期表上处于同一位置的一组核素。如Z为1,A分别为1、2、3的一组核素11H、21H、31H,都是元素氢(H)的同位素。
同位素tongweisu
具有相同核电荷但不同原子质量的原子 (核素) 称为同位素。自19世纪末发现了放射性以后,到20世纪初,人们发现的放射性元素已有30多种,而且证明,有些放射性元素虽然放射性显著不同,但化学性质却完全一样。1910年英国化学家F.索迪提出了一个假说,化学元素存在着原子量和放射性不同而其他物理化学性质相同的变种,这些变种应处于周期表的同一位置上,称做同位素。不久,就从不同放射性元素得到一种铅的原子量是206.08,另一种则是208。1897年英国物理学家W.汤姆逊发现了电子,1912年他改进了测电子的仪器,利用磁场作用,制成了一种磁分离器 (质谱仪的前身)。当他用氖气进行测定时,无论氖怎样提纯,在屏上得到的却是两条抛物线,一条代表质量为20的氖,另一条则代表质量为22的氖。这就是第一次发现的稳定同位素,即无放射性的同位素。当F. W.阿斯顿制成第一台质谱仪后,进一步证明,氖确实具有原子质量不同的两种同位素,并从其他70多种元素中发现了 200多种同位素。到目前为止,已发现的元素有109种,只有20种元素未发现稳定的同位素,但所有的元素都有放射性同位素。大多数的天然元素都是由几种同位素组成的混合物,稳定同位素约300多种,而放射性同位素竟达1 500种以上。
1932年提出原子核的中子一质子理论以后,才进一步弄清,同位素就是一种元素存在着质子数相同而中子数不同的几种原子。由于质子数相同,所以它们的核电荷和核外电子数都是相同的 (质子数=核电荷数=核外电子数),并具有相同电子层结构。因此,同位素的化学性质是相同的,但由于它们的中子数不同,这就造成了各原子质量会有所不同,涉及原子核的某些物理性质 (如放射性等),也有所不同。一般来说,质子数为偶数的元素,可有较多的稳定同位素,而且通常不少于3个,而质子数为奇数的元素,一般只有一个稳定核素,其稳定同位素从不会多于两个,这是由核子的结合能所决定的。
氢有3种同位素,可分别用11H氕 ,21H氘和31H氚表示,也可用11H,21D,31T表示,氧也有168O,178O,188O3种同位素。同位素的发现,使人们对原子结构的认识更深一步。这不仅使元素概念有了新的含义,而且使原子量的基准也发生了重大的变革,再一次证明了决定元素化学性质的是质子数 (核电荷数),而不是原子质量数。
同位素tongweisu
具有相同质子数、不同中子数的原子。一般天然元素是几种同位素组成的混合物。某种同位素的原子数占此种元素总原子数的百分比叫该同位素的丰度,如天然氮气内含有14N和15N两种同位素,每271个氮原子中有270个14N和1个15N,因而14N的丰度为99.63%,15N的丰度为0.37%。化学原子量是该元素的天然组成中同位素质量的平均值,这样不少元素的化学原子量偏离整数。如镁含三种同位素,2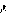 Mg丰度为78.6%,25Mg丰度为10.11%,26Mg丰度为11.29%,得到原子量为24.32。
Mg丰度为78.6%,25Mg丰度为10.11%,26Mg丰度为11.29%,得到原子量为24.32。
根据放射性同位素的性质和特点,人们利用放射性同位素的方法解决了很多技术上的问题,在工农业生产和医药卫生等各方面都起着重要作用。同位素示踪是用放射性核素或稀有稳定核素作为示踪剂,研究化学、生物或其他过程的方法。因为放射性核素或稀有稳定核素的原子、分子及其化合物与普通物质的相应原子分子及其化合物具有相同的化学生物等性质,但放射性核素能不断地发射具有一定特性的射线,通过放射性探测方法追踪含有放射性核素的标记,从而找到各种规律。把同位素示踪方法应用在生命科学中,不但可以了解生物体内生成核酸和蛋白质的复杂过程,甚至可以了解生物遗传是如何实现的,乃至探讨人工改造遗传特征的可能性。因而产生了分子遗传学及遗传工程等新学科。在工业中,示踪原子为使用多种高效能的检验方法及生产过程自动控制的方法提供了可能性。如测定石油在输油管中的流速,研究金属在不同冶炼过程中的结构变化等。在医学上同位素示踪主要用于诊断疾病,已用于医学的同位素不下一百余种。诊断方法有体外脏器显像,比如硫化99TCm胶体经注射进入血液能被肝脏的枯氏细胞摄取,探测仪器在体外的记录,可显示肝脏放射性物质的分布,从而可判断肝脏的大小、形态和位置以及肝脏是否正常,有无肿块等等。这种检查已成为肝癌诊断不可缺少的方法。放射性同位素在农业上的应用包括同位素辐射和同位素示踪两个方面,前者是利用放射性同位素放出的射线能量所造成的生物效应。诸如致死效应、绝育效应和诱变效应等。同位素示踪主要应用在研究农作物的光合作用,体内物质输运,肥料利用,农药残留以及家畜的营养代谢等,从而正确制定作物栽培管理和合理有效地施用肥料和农药的措施,对家畜的饲养和管理提供科学的依据。利用天然放射性同位素的衰变来测定岩石矿物,古生物化石或遗体,以至陨石、地球等的绝对“年龄”,称之为同位素地质年代学。例如在考古工作中,可以利用放射性14C来推算年代。14C的半衰期为5600年。空气中12C和14C存量之比是1012:1.2。植物吸收空气中的二氧化碳,动物又吃植物,所以活着的生物体中碳的这两种同位素存量之比同空气中的比值相同。死后的生物体不再吸收碳,其遗骸中的14C因为衰变逐渐减少。测出古生物遗骸中12C和14C的存量比,同空气中的比值比较,就可以算出古生物体死亡的年代。同位素地质年代学从40年代末以来有了显著的进展,目前已经测定了全球各地区大量岩石的年代数据,根据这些数据建立的地质年表有助于了解地史过程中全球性的地壳运动和岩浆活动的规律,探讨各大陆的形成漂移,了解矿床形成的时代和空间分布的规律等。
同位素isotope
在同一元素中质子数相同而中子数不同的一组核素,互称为同位素。同位素间质量数不同,化学性质相同,物理性质可不同。大多数元素都有同位素:如氯元素核电荷数为17,质量有35与37 2种核素,符号为3517Cl与3717Cl;氢核电荷数为1,质量有1、2、3的3种核素,符号为11H、21H、31H;碳则有126C、136C、146C 3种同位素;碘有12753I、13153I 2种等。同位素中有稳定性同位素与放射性同位素2类。放射性同位素能放射出不可见的α、β、γ等射线,在疾病诊断、恶性肿瘤治疗、医学及生物研究中有重要意义。
同位素
具有相同核电荷数但质量数不同的原子互为同位素。例如氢有三种同位素11H、12H、13H;氧有三种同位素816O、817O 818O。目前已知的同位素达数千种,其中700种以上是原子核不稳定的放射性同位素。除天然放射性同位素外,还有人工放射同位素。同位素的化学性质几乎相同,在周期表上占同一位置。
同位素
同属一种元素(即核电荷数相同),但具有不同的质量数的原子。它们的化学性质几乎相同,在周期表中占同一位置。 目前发现的元素只有100余种,但这些元素的同位素达1000种以上。自然界铀的同位素只有铀234(占0.006%)、铀235(占0.714%)、铀239(占99.28%) 3种,但从核爆炸烟云样品中测出10种以上的同位素。有些元素的同位素不稳定,会自发衰变放出α、β、γ等射线,并转变成其他元素的原子核。具有放射性的同位素称放射性同位素,该物质则称“放射性物质”。
同位素isotope
指原子核内质子数相同,而质量数或中子数不同的核素,它们在元素周期表中处于同一位置。如氢有三种同位素:氢(11H)、氘(12H )、氚(13H)。各元素的同位素数量不等。
同位素
isotope
同位素
isotope
- 使婆是什么意思
- 使婢是什么意思
- 使它隆是什么意思
- 使宅是什么意思
- 使宅鱼是什么意思
- 使安定是什么意思
- 使安定平静是什么意思
- 使官是什么意思
- 使官吏清廉, 在均其禄, 厚其俸。是什么意思
- 使客是什么意思
- 使害怕是什么意思
- 使家是什么意思
- 使家庭安乐是什么意思
- 使家庭成员、伴侣或组织分散是什么意思
- 使家庭败落,事业破产是什么意思
- 使家生是什么意思
- 使容器出口朝下,让液体慢慢流出是什么意思
- 使容貌不衰老是什么意思
- 使容貌和衣着好看是什么意思
- 使容颜不老,寿命增加是什么意思
- 使宾式是什么意思
- 使富者安定是什么意思
- 使富贵是什么意思
- 使对方人格或名誉受损害是什么意思
- 使对方有所得是什么意思
- 使对方注意的吆喝声是什么意思
- 使对方的力量崩溃或分裂是什么意思
- 使对自己有利是什么意思
- 使封君之子孙三世而收爵禄是什么意思
- 使小性儿是什么意思
- 使小钱的是什么意思
- 使尖儿是什么意思
- 使尽了三十六板斧是什么意思
- 使尽本事了是什么意思
- 使尽,用尽是什么意思
- 使巧是什么意思
- 使巧儿是什么意思
- 使已取得的成绩再提高一步是什么意思
- 使已成的不利局面好转或恢复原状是什么意思
- 使师之为道出于童子巫医乐师百工之下,则是为师者之罪也。是什么意思
- 使帐是什么意思
- 使平安无事是什么意思
- 使平得宰天下,亦如此肉矣。是什么意思
- 使平稳安定是什么意思
- 使开是什么意思
- 使开始或行动起来是什么意思
- 使开通是什么意思
- 使弄是什么意思
- 使引是什么意思
- 使役是什么意思
- 使役动词是什么意思
- 使役国是什么意思
- 使役牲畜是什么意思
- 使徒是什么意思
- 使徒法规是什么意思
- 使徒行传是什么意思
- 使得是什么意思
- 使得憨钱,治得庄田是什么意思
- 使徙是什么意思
- 使德日记是什么意思