电子亲合势
电子亲合势dianzi qinheshi
亦称电子亲和能,一个基态气态原子得到一个电子形成气态负离子所放出的能量 (即第一电子亲合势),常用符号Y表示。一般用1mol原子计,单位kJ·mol-1。与电离势一样,有的元素也有第二、甚至第三电子亲合势。如:
F(g)+e→F-(g) Y=-322kJ·mol-1它表示1 mol气态氟原子得到1mol电子转变为1mol气态F-时放出的能量为322kJ。又如,氧原子和硫原子形成O2-和S2-的过程及相应的电子亲合势如下:
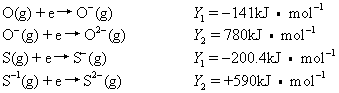
氧和硫的第二电子亲合势Y2是正值,说明由-1价离子难于接受第二个电子,必须给体系做功,体系能量增加,故Y2为正值。同样硒的Y2,氮的Y1,Y2,Y3,以及希有气体元素、碱土金属元素的Y等均为正值。由电子亲合势可判断元素原子得电子的难易或元素非金属性的强弱。非金属元素一般电子亲合势较大,比金属元素易得电子。由于各元素电子亲合势数据不全,测定比较困难,准确性也较差,因而规律性不太明显,应用还不广泛。
☚ 电离势 电负性 ☛
- 经营自由是什么意思
- 经营范围是什么意思
- 经营获利是什么意思
- 经营董事会是什么意思
- 经营蓄积量是什么意思
- 经营要素是什么意思
- 经营规划是什么意思
- 经营规模是什么意思
- 经营规模不大的商人是什么意思
- 经营计划是什么意思
- 经营记录是什么意思
- 经营诊断是什么意思
- 经营谋划,组织安排是什么意思
- 经营谋利是什么意思
- 经营责任是什么意思
- 经营责任制是什么意思
- 经营资金是什么意思
- 经营资金周转是什么意思
- 经营资金来源是什么意思
- 经营资金构成是什么意思
- 经营过程是什么意思
- 经营运输是什么意思
- 经营部是什么意思
- 经营部门是什么意思
- 经营顾问是什么意思
- 经营预测是什么意思
- 经营预算是什么意思
- 经营预算制度是什么意思
- 经营风险是什么意思
- 经营风险分析是什么意思
- 经藏是什么意思
- 经蝶窦蝶鞍内肿瘤切除术是什么意思
- 经血是什么意思
- 经血不定是什么意思
- 经血不断是什么意思
- 经血不止方是什么意思
- 经血夹块是什么意思
- 经血妄行是什么意思
- 经血挟块是什么意思
- 经血暴下是什么意思
- 经血暴下六十五是什么意思
- 经血暴下兼带下是什么意思
- 经血逆行方是什么意思
- 经行是什么意思
- 经行。是什么意思
- 经行下肢瘀血是什么意思
- 经行不利是什么意思
- 经行不寐是什么意思
- 经行不止是什么意思
- 经行不爽是什么意思
- 经行不畅是什么意思
- 经行乳房胀痛是什么意思
- 经行乳胀是什么意思
- 经行便血是什么意思
- 经行先后无定期是什么意思
- 经行先期是什么意思
- 经行先生是什么意思
- 经行入房是什么意思
- 经行发斑是什么意思
- 经行发热是什么意思