活化能与温度的关系
活化能与温度的关系huohuaneng yu wendu deguanxi
一个化学反应的活化能,在不同温度时,其数值是不同的。经过双分子碰撞理论的数学处理,得出阈能Ec与阿仑尼乌斯活化能Ea有如下关系
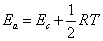
式中RT与气体分子的热运动有关,如理想气体,1mol分子的平均动能为3RT/2。从上式看,阈能Ec 与温度无关,阿仑尼乌斯活化能与温度有
关。但在温度变化不大的情况下,则Ec比1/2RT要大得多,1/2RT可以忽略,得出Ea≈Ec。同样,
从过渡态理论,亦可以得到双分子气相反应,阿仑尼乌斯活化能Ea与活化焓△H≠(近似可视为活化能E)有如下关系
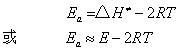
当温度变化不大时,2RT可以忽略,则Ea≈E。因此,在一般情况下 (温度变化不是很大时) 温度对反应速率的影响,无需考虑活化能随温度的改变,可把活化能视为定值来处理。
☚ 阿仑尼乌斯公式 催化剂 ☛
- 一望无垠是什么意思
- 一望无涯是什么意思
- 一望无边是什么意思
- 一望无际是什么意思
- 一望而知是什么意思
- 一朝是什么意思
- 一朝一夕是什么意思
- 一朝天子一朝臣是什么意思
- 一朝权在手,便把令来行是什么意思
- 一木难支是什么意思
- 一本万利是什么意思
- 一本正经是什么意思
- 一条心是什么意思
- 一条街是什么意思
- 一条龙是什么意思
- 一来是什么意思
- 一来一往是什么意思
- 一来二去是什么意思
- 一来二往是什么意思
- 一板一眼是什么意思
- 一枕黄粱是什么意思
- 一枝独秀是什么意思
- 一枝花是什么意思
- 一柱擎天是什么意思
- 一样是什么意思
- 一根筋是什么意思
- 一棍子打死是什么意思
- 一概是什么意思
- 一概而论是什么意思
- 一模一样是什么意思
- 一次性是什么意思
- 一次方程是什么意思
- 一步是什么意思
- 一步一个脚印是什么意思
- 一步到位是什么意思
- 一步登天是什么意思
- 一步裙是什么意思
- 一死一生是什么意思
- 一段是什么意思
- 一毛不拔是什么意思
- 一毫是什么意思
- 一气是什么意思
- 一气呵成是什么意思
- 一氧化碳是什么意思
- 一水儿是什么意思
- 一治一乱是什么意思
- 一波三折是什么意思
- 一波未平,一波又起是什么意思
- 一泻千里是什么意思
- 一派是什么意思
- 一派胡言是什么意思
- 一流是什么意思
- 一清二楚是什么意思
- 一清二白是什么意思
- 一清早是什么意思
- 一溜是什么意思
- 一溜儿是什么意思
- 一溜歪斜是什么意思
- 一溜烟是什么意思
- 一溜风是什么意思