分子型氢化物的分解反应
分子型氢化物的分解反应fenzixing qinghuawu defenjie fanying
非金属元素与氢元素组成的氢化物均为分子型化合物。它们在不同温度下可分解,生成非金属单质和氢气:
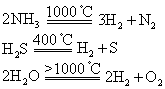
判断氢化物的稳定性可用以下方法:
❶ 氢化物的标准生成吉布斯函数的变化(△G )负,氢化物越易分解,反之则越难分解。这是由于(
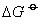 )的值越负时,该物质分解反应的平衡常数越大(
)的值越负时,该物质分解反应的平衡常数越大( ) ,反应的趋势越大。例如,氯化氢、碘化氢的
) ,反应的趋势越大。例如,氯化氢、碘化氢的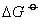 分别为-95.27 kJ·mol-1,1.30 kJ·mol-1,通过计算25℃时下列反应的平衡常数为
分别为-95.27 kJ·mol-1,1.30 kJ·mol-1,通过计算25℃时下列反应的平衡常数为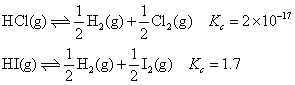 可知,在室温下氯化氢的分解趋势极小,而碘化氢则已开始分解。当温度升高时,△G 的值发生变化,氢化物分解反应的平衡常数一般均增大,使分解趋势加大。例如,氯化氢分解反应的平衡常数1000℃时增至5×10-5,3000℃时又增至1×10-2。
可知,在室温下氯化氢的分解趋势极小,而碘化氢则已开始分解。当温度升高时,△G 的值发生变化,氢化物分解反应的平衡常数一般均增大,使分解趋势加大。例如,氯化氢分解反应的平衡常数1000℃时增至5×10-5,3000℃时又增至1×10-2。❷非金属元素的电负性越大,它与氢元素电负性的差值越大,所形成的氢化物中化学键越牢,分子越稳定。例如,第二周期中,氮、氧、氟的电负性分别为3.0,3.5,4.0,氨气在800 ℃时开始分解,水在1000℃时开始分解,氟化氢高温下也很难分解。再如:ⅦA族的氯、溴、碘,电负性分别为3.0,2.8,2.5,它们的氢化物的分解温度分别为3 000 ℃,1 600℃,300 ℃。一般情况下,同周期非金属元素从左到右,同主族非金属元素自下而上,它们的氢化物越来越稳定。
☚ 金属氧化物的分解 含氧酸的分解 ☛
- 城市土地使用权是什么意思
- 城市土地使用管理是什么意思
- 城市土地使用调查是什么意思
- 城市土地再次开发是什么意思
- 城市土地利用是什么意思
- 城市土地利用是什么意思
- 城市土地利用规划是什么意思
- 城市土地区位利用是什么意思
- 城市土地发展权是什么意思
- 城市土地市场是什么意思
- 城市土地开发是什么意思
- 城市土地所有制是什么意思
- 城市土地投机是什么意思
- 城市土地投资是什么意思
- 城市土地收益是什么意思
- 城市土地有偿使用是什么意思
- 城市土地涉外租赁是什么意思
- 城市土地税收是什么意思
- 城市土地管理是什么意思
- 城市土地管理是什么意思
- 城市土地管理是什么意思
- 城市土地级差收益是什么意思
- 城市土地级差收益是什么意思
- 城市土地经济运行是什么意思
- 城市土地综合开发是什么意思
- 城市土地规划是什么意思
- 城市土地规划是什么意思
- 城市地下工程网道是什么意思
- 城市地价是什么意思
- 城市地域扩散是什么意思
- 城市地域结构是什么意思
- 城市地理信息系统是什么意思
- 城市地理学是什么意思
- 城市地理学是什么意思
- 城市地理学是什么意思
- 城市地理概论是什么意思
- 城市地租是什么意思
- 城市地籍管理是什么意思
- 城市地道桥顶入法施工是什么意思
- 城市地震对策是什么意思
- 城市垃圾处理技术推广项目是什么意思
- 城市基础设施是什么意思
- 城市基础设施是什么意思
- 城市大气污染总量控制方法手册是什么意思
- 城市学是什么意思
- 城市学是什么意思
- 城市学校是什么意思
- 城市学校的兴盛是什么意思
- 城市学概论是什么意思
- 城市学院兴起是什么意思
- 城市定性理论是什么意思
- 城市审计是什么意思
- 城市客流是什么意思
- 城市对外交通用地布局是什么意思
- 城市导线测量是什么意思
- 城市少年是什么意思
- 城市居住用地布局是什么意思
- 城市居民最低生活保障制度是什么意思
- 城市居民生活质量是什么意思
- 城市居民生活质量指标是什么意思