硝酸
一种无机化学产品。无色或带有微黄色、有刺激性气味和强腐蚀性液体。1905年世界上第1座生产硝酸(采用电弧法)的工厂在挪威建成投产,后因经济原因,1930年停产。1908年德国建成了在铂催化剂存在下的氨氧化法制取硝酸的小型工厂(3t/d)。由于合成氨生产的发展,使得这一方法成为工业化生产硝酸的唯一方法。中国第1套硝酸生产装置于1935年在上海天利氮气厂投产。1954年在大连化学厂建成直接合成浓硝酸的生产装置。硝酸生产,从20世纪70年代开始发展比较快,1987年世界硝酸产量达到2800万t,20世纪90年代以来,发展停顿,产量有所下降,1998年约在2100万t左右,其中美国900万t,中国71万t(2000年达82.48万t)。硝酸用于生产硝酸铵(氮肥)、硝酸磷肥、炸药约占总消费量的40%,用于制取染料、医药、农药中间体和有机合成占30%,用于精制提取核燃料钚、合成香料、金属酸洗以及制造其他硝酸盐占30%。
硝酸xiaosuan
化学式HNO3,是氮 (+V) 的含氧酸,是一元强酸。二氧化氮溶于水得到硝酸。硝酸能与水以任何比例混合。纯硝酸是无色透明油状液体,熔点为-42℃,沸点为86℃,相对密度为1.5027。当溶入过量的二氧化氮时,即得发烟硝酸,发烟硝酸是红褐色液体,在空气中猛烈发烟并吸收水分。纯硝酸自电离式为:
2HNO3=NO+2+NO-3+H2O
NO+2的存在对有机化学中的硝化反应具有重要意义。硝酸加热或受光照时会放出二氧化氮,故通常将硝酸保存于棕色瓶中,实验室常用的浓硝酸密度为1.41g· mL-1,约含 HNO368% (浓度相当于15mol·L-1)。硝酸分子中氮与氧原子除形成共平面的σ键外,氮的π轨道中一对电子和两个氧原子中的π电子还形成三中心四电子离域π键π43。在NO-3中,由于H+给硝酸根一个外来电子,共有6个电子,故除了σ键外,还有氮与3个氧原子形成的四中心六电子π键π64。硝酸的氧化性较强,可氧化许多非金属单质,如:
5HNO3+P=H3PO4+5NO2+H2O
2HNO3+S=H2SO4+2NO
10HNO3+3I2=6HIO3+10NO+2H2O
硝酸与金属作用,反应产物比较复杂。金属被氧化后的产物,一般说来有4种情况:
❶氧化成可溶性盐,如硝酸铜、硝酸银等。
❷易溶于稀硝酸,但不溶于浓硝酸,如铝、铁、铬等,这是表面钝化的结果。
❸氧化成氧化物,此种氧化物不溶于硝酸,如三氧化钼、三氧化钨、二氧化锡等。
❹ 某些贵金属,如,金、铂、铱等,不与硝酸作用。硝酸与盐酸的混合物 (摩尔比1:3) 叫做王水,可溶解金、铂等贵金属。
硝酸和金属作用后,本身还可能被还原为一系列还原程度不同的化合物如
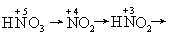
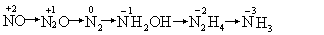
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
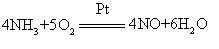
NaNO3+H2SO4=NaHSO4+HNO3
硝酸有着广泛的用途,是三大强酸之 一,它是制造炸药、染料、塑料、硝酸盐和许多其他化学产品的重要原料,也是实验室最常用的试剂之 一。
硝酸nitric acid
系强酸之一。分子式为HNO3,无色,易挥发,有刺激性气味,密度为1.5g/cm3,沸点为86℃,能与水以任何比例混和,98%以上浓度的为浓硝酸。硝酸不稳定,在常温下见光或受势极易分解;硝酸是一种强氧化剂,几乎能使所有金属发生成盐反应。硝酸是重要工业原料,用途广泛;医学界及制药业亦广被应用。
硝酸Xiaosuan
重要的强酸之一。化学式HNO3。纯硝酸为无色透明油状液体,熔点-42℃,沸点83℃,市售浓硝酸含HNO368—70%,硝酸可以与水以任意比混合。工业上采用氨氧化法制备硝酸,首先将氨与空气在800—900℃由铂丝网催化燃烧,得到一氧化氮,一氧化氮与过量氧气反应形成二氧化氮,二氧化氮溶于水即得到硝酸。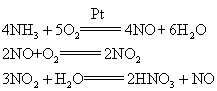
硝酸具有强酸性,它能与碱或碱性氧化物反应形成盐和水。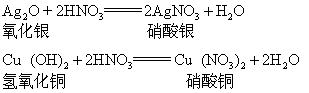
硝酸是氧化性酸,它可以溶解大多数金属,形成可溶性的硝酸盐,但不放出氢气,而是形成二氧化氮或一氧化氮等,一般浓硝酸主要产生二氧化氮,稀硝酸主要产生一氧化氮。如: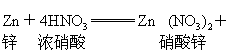
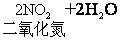
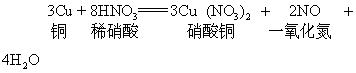
硝酸与蛋白质发生反应产生黄色物质,叫做黄蛋白反应,硝酸滴在皮肤上留下黄色斑点就是这个原因,硝酸对皮肤,织物都有腐蚀性。硝酸的主要用途是制造炸药和化肥,硝酸与甘油形成硝化甘油,硝酸与甲苯形成三硝基甲苯、硝酸与纤维素形成硝化纤维,都是应用广泛的炸药,硝酸铵是含氨量较高的速效氮肥。
硝酸
强酸之一,分子式为HNO3。纯硝酸是无色液体,易分解出二氧化氮,因而呈红棕色。常用的浓硝酸约含HNO365%,比重为1.40。具有强烈的刺激气味和腐蚀性。是强氧化剂,能使铁钝化而不致继续被腐蚀。是一种重要的化工原料,广泛应用于氮肥、合成纤维、炸药、染料等工业。工业上一般采用氨氧化法制得。
硝酸
nitric acid
硝酸
nitric acid
硝酸
nitric acid
- 仁斋小儿方论是什么意思
- 仁斋小儿方论是什么意思
- 仁斋直指是什么意思
- 仁斋直指是什么意思
- 仁斋直指是什么意思
- 仁斋直指小儿方论是什么意思
- 仁斋直指小儿方论是什么意思
- 仁斋直指小儿附遗方论是什么意思
- 仁斋直指方论是什么意思
- 仁斋直指方论(附补遗)是什么意思
- 仁明是什么意思
- 仁昶钱庄是什么意思
- 仁显王后传是什么意思
- 仁晁法师是什么意思
- 仁智是什么意思
- 仁智之行是什么意思
- 仁智者寿是什么意思
- 仁暴亡国是什么意思
- 仁本第一是什么意思
- 仁术是什么意思
- 仁术便览是什么意思
- 仁术便览是什么意思
- 仁术便览是什么意思
- 仁术肩墙录是什么意思
- 仁民爱物是什么意思
- 仁民爱物是什么意思
- 仁浆义粟是什么意思
- 仁济医院是什么意思
- 仁济和水火保险公司是什么意思
- 仁熟散是什么意思
- 仁熟散是什么意思
- 仁爱是什么意思
- 仁爱会是什么意思
- 仁爱说是什么意思
- 仁献章圣皇后(亦乞烈氏)是什么意思
- 仁王护国般若波罗蜜经疏是什么意思
- 仁王经是什么意思
- 仁社是什么意思
- 仁祖弹弦是什么意思
- 仁祠是什么意思
- 仁科芳雄是什么意思
- 仁科芳雄是什么意思
- 仁科芳雄(1890—1951)是什么意思
- 仁端录是什么意思
- 仁端录是什么意思
- 仁端录十六卷 明 徐谦是什么意思
- 仁端录痘疹是什么意思
- 仁竹法师是什么意思
- 仁美是什么意思
- 仁者是什么意思
- 仁者是什么意思
- 仁者是什么意思
- 仁者人也是什么意思
- 仁者必有勇是什么意思
- 仁者必有勇,勇者不必有仁是什么意思
- 仁者无敌是什么意思
- 仁者浑然与物同体是什么意思
- 仁者能仁于人,而不能使人仁是什么意思
- 仁者见之谓之仁,知者见之谓之知是什么意思
- 仁者见仁,智者见智是什么意思