盐水解的计算
盐水解的计算yan shuijie de jisuan
盐的离子与水电离出的H+或OH-作用生成弱酸、弱碱的反应叫盐的水解。此溶液中除了有水的电离平衡外还存在着第二个电离平衡(弱酸或弱碱)。具体计算按3种盐进行:
❶ 弱酸强碱盐水解 如
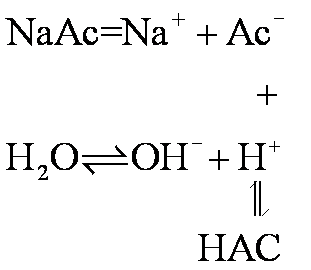
AC-+H2O![]() OH-+HAC
OH-+HAC
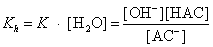
Kh是盐水解达平衡的常数,称水解常数,其大小与水的离子积常数和酸的解离常数有关。由
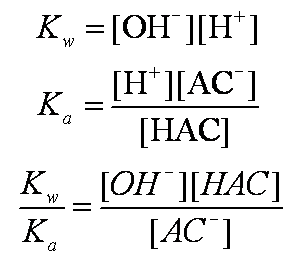
![]()

此公式可计算弱酸强碱盐水解的pH值。例如,醋酸的电离常数Ka=1.76×10-5,0.025mol·L-1的NaAc溶液pH为:
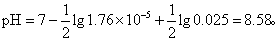
❷ 强酸弱碱盐水解 如浓度为c盐的NH4Cl盐水解:
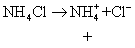

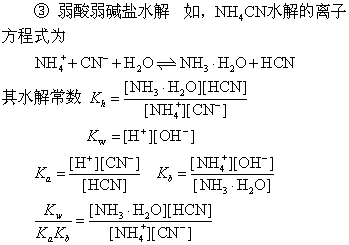
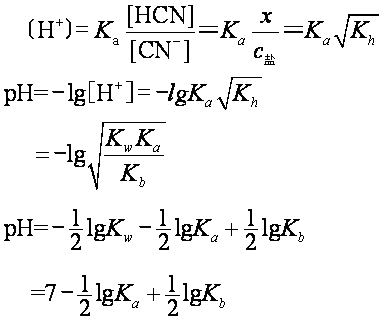
Ka=Kb pH=7 溶液呈中性
Ka>Kb pH<7 溶液呈酸性
Ka
NH4AC溶液呈中性是由于HAC的Ka=1.76×10-5,NH3·H2O的Kb=1.79×10-5,二者几乎相等,pH=7。但它与强酸强碱盐pH=7有本质的不同。
将以上3种盐水解的计算公式归纳如下:
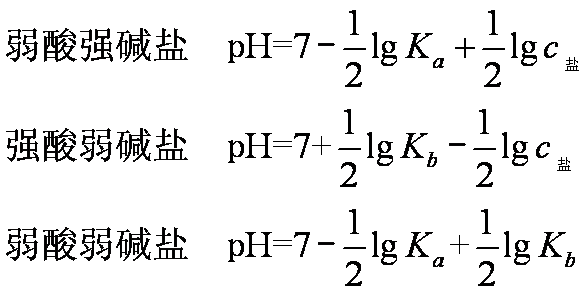
另外,对于多元弱酸盐,如Na2CO3,水解时呈碱性,水解是分步进行的,而第一步水解远大于第二步水解,所以计算时均以第一步水解为主。多元弱碱盐,如Al2(SO4)3,水解也是分步进行的,以第一步水解为主,第二、第三步水解较困难。它们水解产生的酸性主要来自第一步水解,产物还会有沉淀析出。
盐水解时除计算其溶液的pH之外,还可计算水解度,即盐水解的百分率,用h表示。

☚ 电离常数的计算 缓冲溶液的计算 ☛
- 信以传信是什么意思
- 信以传信,疑以传疑是什么意思
- 信以传信;疑以传疑是什么意思
- 信以守之,忠以成之,敏以行之是什么意思
- 信以守物。是什么意思
- 信以守礼, 礼以庇身; 信、礼之亡, 欲免, 得乎?是什么意思
- 信以接物,宽以待下是什么意思
- 信以结之,则民不倍是什么意思
- 信仰是什么意思
- 信仰·经籍·教义是什么意思
- 信仰与幸福是什么意思
- 信仰与私利是什么意思
- 信仰与超越: 卢卡契文艺美学思想论稿是什么意思
- 信仰主义是什么意思
- 信仰习俗是什么意思
- 信仰佛教者的入教仪式是什么意思
- 信仰危机是什么意思
- 信仰同一宗教者是什么意思
- 信仰和崇拜是什么意思
- 信仰哲学家是什么意思
- 信仰坚持偏差是什么意思
- 信仰型犯罪心理是什么意思
- 信仰学是什么意思
- 信仰宗教是什么意思
- 信仰崇奉是什么意思
- 信仰并敬奉是什么意思
- 信仰并遵守的准则是什么意思
- 信仰性消费习俗是什么意思
- 信仰明教是什么意思
- 信仰民俗是什么意思
- 信仰活动是什么意思
- 信仰活动场所是什么意思
- 信仰的事是什么意思
- 信仰神学是什么意思
- 信仰自由是什么意思
- 信仰行动是什么意思
- 信仰)(绿原)是什么意思
- 信仲是什么意思
- 信件是什么意思
- 信件分拣传送带是什么意思
- 信件分拣机是什么意思
- 信件分拣架是什么意思
- 信件收回是什么意思
- 信件的套是什么意思
- 信件秤是什么意思
- 信件自动分拣是什么意思
- 信件邮寄是什么意思
- 信件邮寄服务是什么意思
- 信件邮资是什么意思
- 信任是什么意思
- 信任与不信任阶段是什么意思
- 信任与安慰者协会是什么意思
- 信任与猜疑是什么意思
- 信任依靠是什么意思
- 信任和倚托是什么意思
- 信任喜爱是什么意思
- 信任委托是什么意思
- 信任宠爱是什么意思
- 信任已极是什么意思
- 信任并依靠是什么意思