激素作用机理
激素在血循环中存在的量极微,例如蛋白质激素在血循环中的浓度为10-10~10-12mol/L,类固醇激素的浓度为10-6~10-9mol/L,但它们产生的生理效应都很显著。激素通过以下两种作用而产生生理效应:
❶通过细胞膜上受体的作用: 激素与细胞膜上的受体作用,产生一种或几种细胞内的信使,再由信使继续作用,激活某些酶或影响酶蛋白的合成等。
❷通过细胞内受体的作用: 激素进入细胞内,与细胞内的可溶性受体相结合,结合后所生成的复合体被运输到细胞核内,激活了特异的基因,合成某些蛋白质。
属于第一种作用机理的有肽类蛋白质激素和胺类激素及前列腺素,属于第二种作用机理的有类固醇激素和甲状腺激素。对有些激素的作用机理研究得比较清楚,如肾上腺素和胰高糖素,有的则不太清楚,如胰岛素和甲状腺素等。
通过细胞膜上受体的作用机理cAMP——第二信使学说 肽类蛋白质激素和胺类激素随血流抵达靶细胞后,与靶细胞细胞膜上的受体特异地结合,促使膜上的腺苷酸环化酶活性增加,催化胞浆中ATP生成cAMP。继而由于胞浆中cAMP浓度的增加而激活了蛋白激酶,活化了的蛋白激酶又可使某些酶或其他蛋白质发生磷酸化作用,从而改变其活性,产生生理效应(图1)。
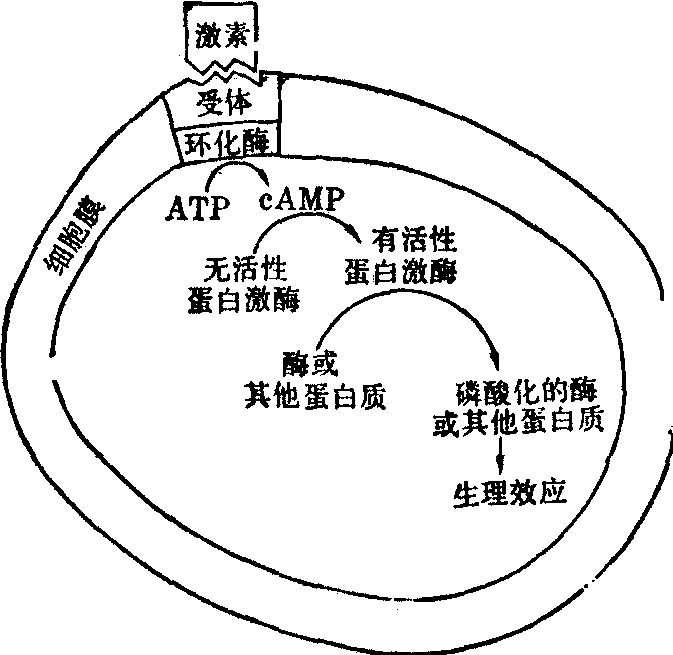
图1 激素通过细胞膜上受体的作用机理
1958年Sutherland首次从加肾上腺素或胰高糖素的肝匀浆中分离出cAMP,此物质系细胞膜中的腺苷酸环化酶作用于胞浆中的ATP所生成,胞浆中的磷酸二酯酶则催化cAMP的磷酸二酯键的水解,生成5′-腺苷酸而失活。腺苷酸环化酶存在于哺乳动物的所有组织细胞中 (成熟红细胞例外) 是细胞膜中的一种靠近内侧的嵌入蛋白质,它紧密地与靠近膜外侧的另一种嵌入蛋白质即激素的受体相联系。
以肾上腺素和胰高糖素对肝细胞和脂肪细胞的作用为例,其作用机理如图2、图3。
蛋白激酶是催化蛋白质(包括酶)发生磷酸化作用的一类酶,被催化的酶有的经磷酸化作用后从无活性变为有活性,如磷酸化酶b激酶和脂肪酶,但也有的酶经磷酸化作用后从有活性变为无活性,如糖原合成酶。
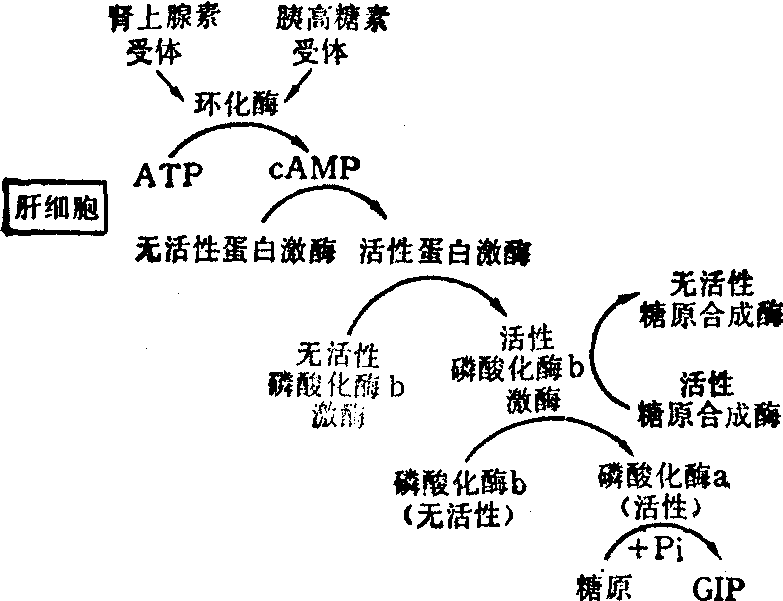
图2 肾上腺素和胰高糖素对肝细胞作用机理
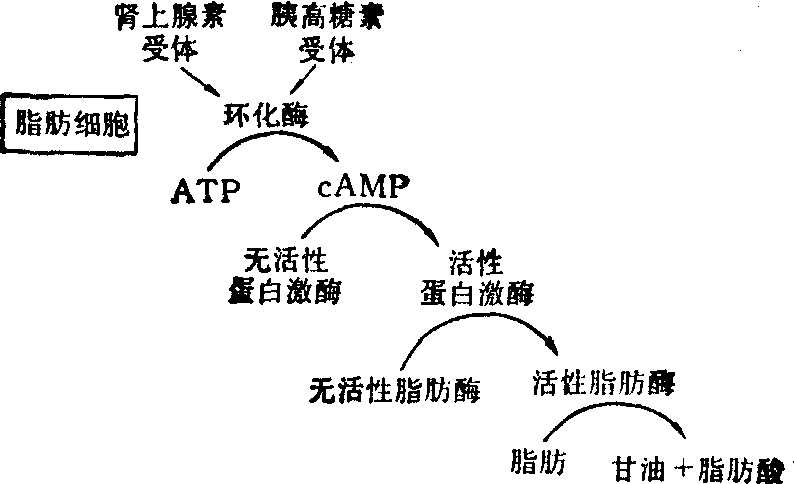
图3 肾上腺素和胰高糖素对脂肪细胞作用机理
从上面可以看到这类激素在靶细胞内所引起的作用都会引起cAMP的增加,因此cAMP是“第二信使”(激素是第一信使)。
在许多情况下,发现这类激素的作用还必需有Ca2+的存在,因此认为Ca2+是另一个第二信使。另一种环核苷酸,即环磷酸鸟苷 (cGMP)也被认为是一种第二信使,并且它的浓度增减往往与cAMP相反,两者有拮抗作用,其关系与祖国医学中的“阴阳学说”有某些相似。
通过细胞内受体的作用机理 类固醇激素随血液抵达靶细胞后,并不停留在细胞表面,而是通过细胞膜扩散进入到细胞内。细胞浆中存在着可溶性的各种类固醇激素的受体,可以特异地和它相应的类固醇激素相结合,形成激素受体复合物。此复合物经过一定的构象的变化后,可以进入细胞核与染色质某部位基因区结合,从而促进某些mRNA的转录合成。所合成的mRNA离开胞核到胞浆中与核糖体结合,引起特异蛋白质的合成,于是产生了激素的特定生理效应。(图4)
甲状腺激素随血流抵达靶细胞后,也是通过细胞模扩散到细胞内去的,但目前尚未能在细胞浆中发现特异的甲状腺激素受体。在肝、肾等的细胞核及线粒体上发现有甲状腺激素的受体,其详细作用机理尚不清楚。
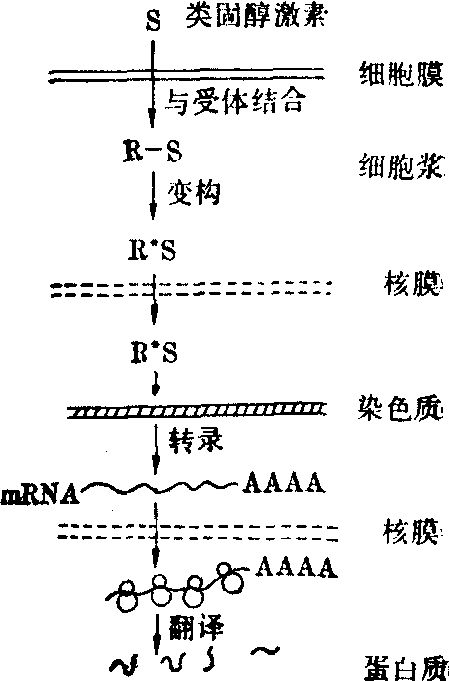
图4 类固醇激素作用机理
激素作用机理
激素作用于靶细胞而发生强大生物效应已较明确,但其作用部位、如何起生理或病理生理作用,其机理与方式等至今尚未完全阐明。一般认为激素必须与靶细胞的特异性受体结合后方可起生物效应。受体是激素起作用的部位,有非常高的专一性和特异性,可位于靶细胞膜、核或胞液中,受体的性质大都是蛋白质(糖蛋白或脂蛋白)。目前就受体部位、激素化学结构及已知的作用方式大致可分为三大类,但尚有不少激素的确切作用机理未明,或可能尚有其他作用方式。
通过细胞膜受体调节 此组激素包括大部分肽类、蛋白质类及儿茶酚胺类,作用于细胞膜受体后经下列步骤发生生物效应。
激素和受体结合
❶识别(结合): 激素受体有高度特异性,甲肽受体仅能与甲肽结合而不与乙肽结合,除非乙肽中结合部分有与甲肽相同结构,则可发生交叉结合,结合后发生激素受体结-复合物。
❷ 激活细胞膜内酶系,再引起下列变化。由于激素与激素受体有高度亲和力,受体对微量激素非常敏感,虽激素浓度极低亦能相互结合而起生物效应,且其强弱与结合量呈正相关,此种结合属非共价键结合,故是可逆的。
激素和受体结合的后果
❶改变细胞膜通透性: 由于细胞膜内酶系被激活后膜的通透性有改变,可促进许多物质通过细胞膜进入胞内,如胰岛素能促进肌细胞和脂肪细胞膜对葡萄糖和某些氨基酸的转运入胞内。此种生理作用似乎不一定通过第二信使. 很多肽类或蛋白激素也能促进Ca++透入细胞,并在调钙素与Ca++的作用下发生生物效应.
❷改变细胞膜上酶活性: 很多肽类激素与受体结合后,引起靶细胞膜上腺苷酸环化酶活性改变,据近年研究,可能在此激素受体-复合物和腺苷酸环化酶之间尚有“联系物”或“调节物”存在,此种联系物可能包含有鸟苷酸三磷酸(GTP),可使腺苷酸环化酶变构,增高酶蛋白活性和ATP的亲和力,从而加强转化为cAMP,同时GTP本身则转化为GDP。激素为第一信使,生成的cAMP,作为第二信使,能传递激素信息,产生多种激素效应。据目前所知,并非所有肽类激素能通过cAMP作为第二信使,不少激素已查明,兹列表如下:(表1)
细胞内cAMP的调节 由于腺苷酸环化酶分布很广,除成熟红细胞外,存在于几乎哺乳动物的全部组织细胞膜上,ATP受催化而形成cAMP,故细胞内cAMP的水平首先受腺苷酸环化酶的调节。cAMP生成后又受磷酸二酯酶的控制,此酶存在于细胞的颗粒部分和可溶部分,能使cAMP中3′磷酸酯键水解而生成5′-AMP。前述二
表1 肽类激素与cAMP之间的关系
| 通过cAMP为 第二信使的激素 | 不通过cAMP为 第二信使的激素 |
| ACTH LH HCG FSH TSH LPH MSH ADH TRH PTH CT | 胰岛素 类胰岛素生长因子 生长介素 表皮生长因子(EGF) 纤维母细胞生长因子(FGF) 神经生长因子(NGF) GH PRL 胎盘泌乳素 催产素 生长素释放抑制激素(GHRIH, SS) |
| 胰高糖素 儿茶酚胺(β-肾上腺素能) PGE1 | 儿茶酚胺(α-肾上腺素能) △PGF2α *血管紧张素Ⅱ *LRH |
*可能不通过cAMP △于黄体细胞中PGF2α降低cAMP表中简称可查本卷略语检索表。
部反应均受Mg++激活,也受钙(Ca++)离子的调节。当Ca++浓度升高时对cAMP的生成起抑制作用而对磷酸二酯酶则起促进作用,故cAMP将降低。Ca++本身在调钙素的结合下起反应,故有人将Ca++称为第二信使。

cAMP的生理作用 许多肽类激素均使细胞内cAMP升高,据目前所知,由于不同细胞内有不同的酶系,发生不同的生理作用。但首先cAMP将激活蛋白激酶,然后再激活一系列的磷酸化酶等而起作用。
(1) 蛋白激酶的激活过程:受cAMP激活的蛋白激酶又称cAMP依赖性蛋白激酶,由二个亚基组成,一是催化亚基,有催化蛋白质磷酸化作用,另一是调节亚基,是前者的抑制物。当此二亚基结合时,酶呈抑制状态。当cAMP和调节亚基结合,使催化亚基脱离时,起激活蛋白激酶作用(图1)。
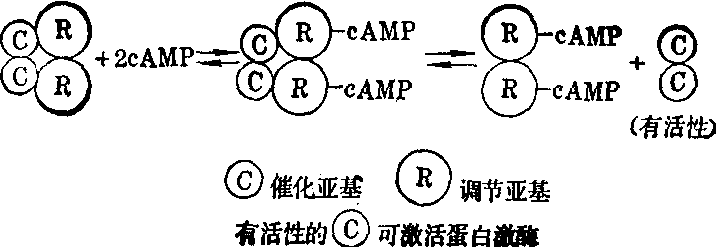
图1 cAMP激活蛋白激酶示意图
(2)蛋白激酶的催化作用:酶蛋白磷酸化后,其活性可被激活或抑制。如磷酸化酶b激酶受蛋白激酶激活后,利用ATP将无活性磷酸化酶b磷酸化,成为有活性的磷酸化酶a,促进糖原分解.糖原合成酶Ⅰ则可经磷酸化而抑制糖原合成。同样,蛋白激酶也可使脂肪酶等激活或
表2 cAMP-蛋白激酶系统对酶的修饰作用
| 被磷酸化的酶 | 活性改变 | 代谢影响 |
| 磷酸化酶b激酶 糖原合成酶Ⅰ 丙酮酸激酶(肝) 果糖二磷酸酶(肝) 甘油三酯脂肪酶 乙酰CoA羧化酶 α-磷酸甘油转酰基酶 HMG CoA还原酶 胆固醇酯酶 | 激活 抑制 抑制 激活 激活 抑制 抑制 抑制 激活 | 激活磷酸化酶 抑制糖原合成 抑制葡萄糖酵解 促进糖异生 促进脂肪分解 抑制脂肪酸合成 抑制脂肪合成 抑制胆固醇合成 促进肾上腺皮质、性腺激 素合成 |
| 酪氨酸羟化酶 | 激活 | 促进儿茶酚胺合成 |
因此,除前述cAMP学说外,还有cGMP学说,Ca++作为第二信使学说。cGMP广泛分布于很多组织,但其浓度较cAMP小数倍至数十倍。目前已认为cGMP是胆碱能神经M受体的突触后递质,可能和某些激素信息传递有关,如生长激素释放抑制激素似乎以cGMP为第二信使。胰岛素在降低肝和脂肪细胞中cAMP的同时,cGMP常升高,但此作用似有赖于Ca++的存在,故在胰岛素作用机理中cGMP作为第二信使的认识几乎已被否定。Ca++可促进磷酸化酶b激酶的活性,也可激活脂肪酶等,故有人提出作为某些肽类激素的第二信使,如胰岛素作用于靶细胞并不引起cAMP变化,而首先使膜上结合的Ca++发生置换,改变膜的稳定性,促进葡萄糖和钾离子等进入细胞内,同时抑制胞内Ca++外溢,导致细胞内Ca++上升,明显抑制蛋白激酶活性,继而促进磷酸化而发生生理作用,但此说也未被普遍接受。近年来尚有提示进入细胞内的肽类激素,已用电镜自动放射显影术证明,如胰岛素、催乳素、甲状旁腺激素、表皮生长因子等进入细胞内,起生物效应而后者可能直接作用于核。因此胰岛素不仅作用于细胞膜受体,促进葡萄糖等进入细胞与酶系活动,而且进入细胞内与核、内质网、高尔基体等结构结合,导致DNA、RNA和蛋白质等合成。目前胰岛素受体已知为糖蛋白,但其化学结构仅初步明确(类似免疫球蛋白),其作用机理等尚在研究中。
为了总结上述细胞膜上受体类型的多肽类作用机理,举胰高糖素为例以图2说明如下。
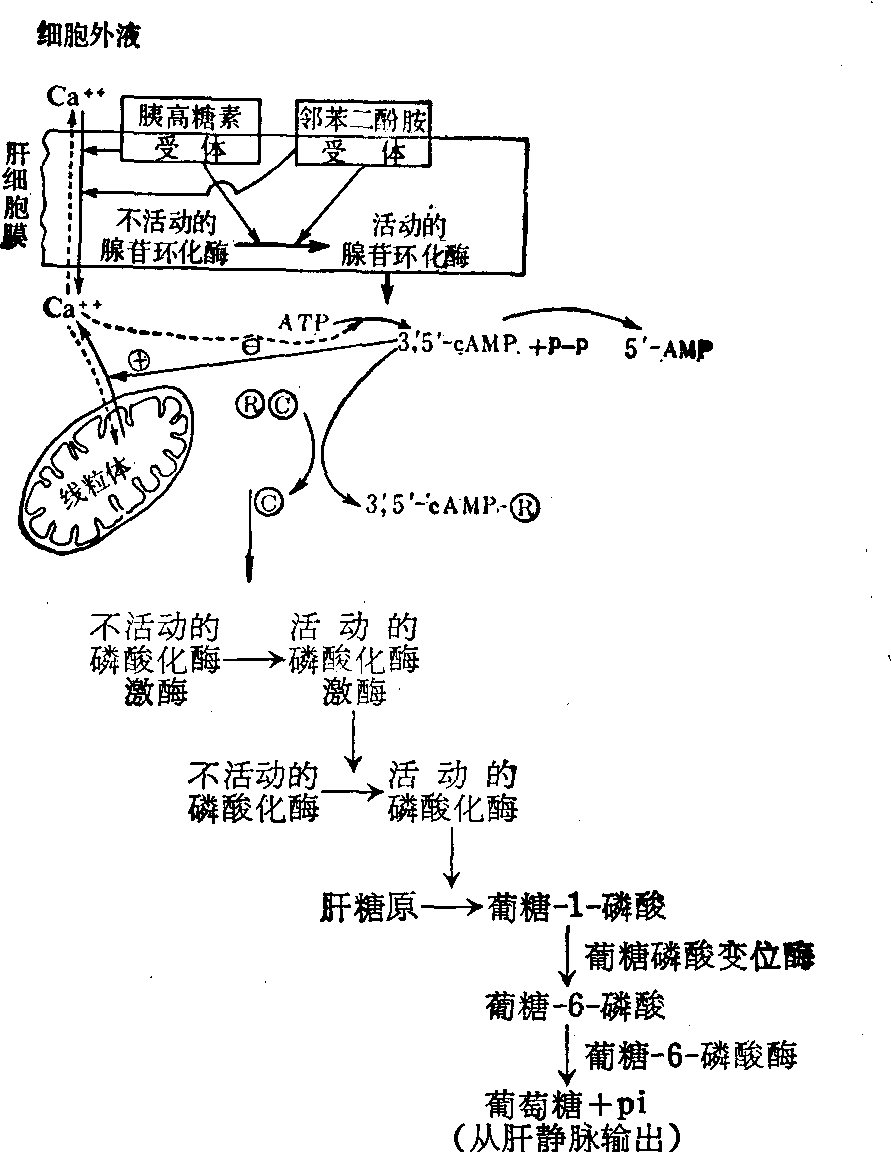
图2 示胰高糖素、邻苯二酚胺作用于肝细胞膜特异性受体促进肝糖原分解为葡萄糖,经肝静脉输出,从而纠正低血糖症3′,5′-cAMP,3′,5′-环化腺苷一磷酸 P~P高能磷酸键p1无机磷酸基 Ⓡ调节亚单位 Ⓒ催化亚单位 ⊕示促进 ⊖示抑制
通过细胞液受体调节 此组包括类固醇激素 (性激素及肾上腺皮质激素)及维生素D族激素。此组类固醇激素属脂溶性,在血循环中必须与蛋白质结合而运转,但仅有极小游离部分能进入细胞而发生作用。目前以雌二醇与孕酮对子宫和输卵管的实验研究比较详细,皮质醇、醛固醇则可能有类似机理。兹将此类甾体激素作用机理概述如下:
甾体激素与胞浆内受体结合而入核过程 甾体激素属脂溶性,故能通过细胞膜进入胞液,与受体蛋白结合(属可逆性共价键结合),亦具有高度特异性与亲和力。如子宫中雌二醇受体仅能与具有生理功能的雌二醇-17β结合,却不能与无活性的异构体雌二醇-17α结合,可见其高度特异性与生理功能相关。当激素受体结合后入核前尚须改变其构型,形成一有利于与染色体有高度亲和力的结构,如雌二醇受体复合物在胞液中为4S,分子量约75,000~80,000道尔登,入细胞核后则为5S,分子量为133,000,故核内激素受体结合成的复合物具有活性,能与染色质结合,称为活性复合物。
活性复合物对染色质的作用 此活性复合物与靶细胞内核中染色质的结合亦有高度特异性和亲和力。如孕酮的活性复合物仅能与子宫和输卵管靶细胞的染色质结合,不能与心、肺、脾、肠等非靶细胞的染色质结合,且此种高度特异性结合的染色质上还有二种特定的接受部位:
❶ DNA接受部位:活性复合物可直接与DNA结合。但只有小量复合物能与DNA的一些特异部位进行较高亲和力的结合,改变DNA构型,有利于基因转录。
❷非组蛋白接受部位:即酸性蛋白AP3,含有丝氨酸,磷酸化程度较高,带负电荷,可与带正电荷的碱性组蛋白相互作用,去除覆盖在DNA分子上的蛋白质阻抑,使DNA上某一基团活化,随后将活性复合物中的A亚基解离,并与DNA相互作用,使一分子RNA聚合酶在DNA上开始转录,产生一单链信息核糖核酸(mRNA)作为模板翻译成诱导蛋白。此诱导蛋白能活化RNA聚合酶,促进核内各种RNA合成,包括mRNA、rRNA、tRNA,进而加速各种蛋白质合成,发生生理效应。如孕酮作用于输卵管时,活性复合物入细胞核分成A、B两个亚基,分别与DNA及非组蛋白结合后促进转录,诱导特异蛋白质的合成,即卵白蛋白,又称抗生物素蛋白。
通过核内受体调节 据近年研究已知甲状腺激素受体在核内,其作用机理,较近似于类固醇激素,但也有不同。当甲状腺激素分泌入血循环运转时,绝大部分(>99.5%)亦与糖蛋白结合成甲状腺激素结合蛋白(TBG),但起生理作用的是游离部分的T3、T4,尤其是T3是进入核后与蛋白质结合成复合物的成分。当甲状腺激素T4、T3进入细胞液后,T4转化为T3及其他脱碘代谢产物,部分T3与胞液内某些蛋白结合,其余入核与核内受体蛋白(酸性的非组蛋白)结合成复合物。此复合物再与染色质中DNA结合通过转录而形成RNA多糖、rRNA、tRNA,再通过翻译成成熟的mRNA,出核,作用于胞浆中蛋白质酶系而起生理效应。
- md200706049_019003001001是什么意思
- md200706049_019003001002是什么意思
- md200706049_019003001003是什么意思
- md200706049_019003001004是什么意思
- md200706049_019003001005是什么意思
- md200706049_019003001006是什么意思
- md200706049_019003001007是什么意思
- md200706049_019003001008是什么意思
- md200706049_019003001009是什么意思
- md200706049_019003002是什么意思
- md200706049_019003002001是什么意思
- md200706049_019003002002是什么意思
- md200706049_019003002003是什么意思
- md200706049_019003002004是什么意思
- md200706049_019003002005是什么意思
- md200706049_019003002006是什么意思
- md200706049_019003002007是什么意思
- md200706049_019003002008是什么意思
- md200706049_019003003是什么意思
- md200706049_019003003001是什么意思
- md200706049_019003003002是什么意思
- md200706049_019003003003是什么意思
- md200706049_019003003004是什么意思
- md200706049_019003003005是什么意思
- md200706049_019003003006是什么意思
- md200706049_019003003007是什么意思
- md200706049_019004是什么意思
- md200706049_019004001是什么意思
- md200706049_019004001001是什么意思
- md200706049_019004001002是什么意思
- md200706049_019004001003是什么意思
- md200706049_019004001004是什么意思
- md200706049_019004001005是什么意思
- md200706049_019004001006是什么意思
- md200706049_019004001007是什么意思
- md200706049_019004001008是什么意思
- md200706049_019004001009是什么意思
- md200706049_019004001010是什么意思
- md200706049_019004001011是什么意思
- md200706049_019004001012是什么意思
- md200706049_019004001013是什么意思
- md200706049_019004001014是什么意思
- md200706049_019004001015是什么意思
- md200706049_019004001016是什么意思
- md200706049_019004001017是什么意思
- md200706049_019004001018是什么意思
- md200706049_019004001019是什么意思
- md200706049_019005是什么意思
- md200706049_019005001是什么意思
- md200706049_019005001001是什么意思
- md200706049_019005001002是什么意思
- md200706049_019005001003是什么意思
- md200706049_019005001004是什么意思
- md200706049_019005001005是什么意思
- md200706049_019005001006是什么意思
- md200706049_019005001007是什么意思
- md200706049_019005002是什么意思
- md200706049_019005002001是什么意思
- md200706049_019005002002是什么意思
- md200706049_019005002003是什么意思