中和滴定的计算
中和滴定的计算zhonghediding de jisuan
利用中和滴定可以测定酸(或碱)溶液的未知浓度。计算公式按如下方法导出。酸(A)、碱(B)中和时的反应:aA+bB=产物。中和时酸与碱的物质的量之比是a/b。
设酸、碱的摩尔浓度分别是cA,cB,溶液的体积分别是VA,VB,它们的物质的量分别是cAVA,cBVB。有下式成立:
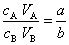
例1 在锥形瓶中注入20mL Na2CO3溶液,用0.5mol·L-1盐酸进行滴定,完全反应用去盐酸18mL,计算Na2CO3溶液的摩尔浓度。
解 设Na2CO3溶液的摩尔浓度是cB。根据化学方程式,完全反应时,HCl和Na2CO3的物质的量之比是2/1=2。
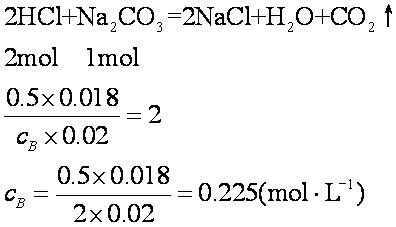
答 Na2CO3溶液摩尔浓度0.225mol·L-1。
应用中和滴定确定酸碱浓度的计算可与溶液的稀释、混合等问题联系起来。
例2取密度为1.19g·mL-1的盐酸5mL,移入100mL容量瓶中,加水稀释到刻度,取这种盐酸20mL进行滴定,达终点时,用去0.5mol·L-1的NaOH溶液24mL,原有盐酸含HCl为百分之几?
解 设盐酸的摩尔浓度为CB:

答 原有盐酸含HCl为36.8%。
利用酸、碱中和反应,使一种已知浓度的溶液对另一种未知浓度的溶液进行滴定,从反应所需溶液的体积关系,可以计算出样品中某种成分的含量,这种方法叫中和法。
例3 称取硫铵样品2g,加过量NaOH溶液进行加热,把生成的氨气通入60mL的0.25mol·L-1硫酸溶液中吸收,当滴定多余的硫酸时,消耗0.2mol·L-1NaOH溶液2mL,求样品中硫铵的百分含量。
解 根据 H2SO4+2NH3=(NH4)2SO4
H2SO4+2NaOH=Na2SO4+2H2O
设NH3的物质的量为x mol,硫铵质量为y g:
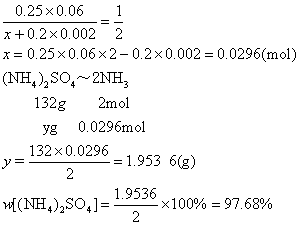
答 样品中硫铵的百分含量为97.68%。
应用中和法可求物质的相对分子质量、相对原子质量。
例 4 烧杯里装有 4mol· L-1 NaOH溶液40mL,加入固态铵盐(NH4X)4.28g,加热至反应完全后,把溶液稀释至500mL,量取40mL稀释液进行滴定,达终点时,用去0.4mol·L-1盐酸16mL,试计算铵盐的相对分子质量和X的相对原子质量。
分析 求化合物的相对分子质量,也就是求化合物的摩尔质量。
解 40mL NaOH溶液含NaOH的物质的量为
4×0.04=0.16(mol)
根据 NaOH+HCl=NaCl+H2O完全中和时,酸、碱的物质的量相当。40mL稀释液中含NaOH的物质的量为0.4×0.016 500mL稀释液中含NaOH的物质的量为
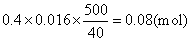
0.16-0.08=0.08(mol)
❶求铵盐的相对分子质量
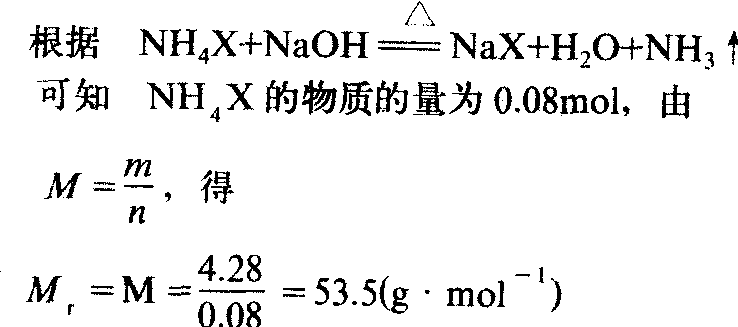
❷求X的相对原子质量根据分子式 NH4X 14+1×4+Ar=53.5
Ar=35.5
答 铵盐的相对分子质量为53.5,X的相对原子质量为35.5。
☚ 反应物与生成物的量的计算 纯度的计算 ☛
- 眼红心毒是什么意思
- 眼红心烧是什么意思
- 眼红气涨是什么意思
- 眼红眼绿是什么意思
- 眼红眼黑是什么意思
- 眼红红是什么意思
- 眼红绝毒是什么意思
- 眼红面青是什么意思
- 眼约心期是什么意思
- 眼纱是什么意思
- 眼纹是什么意思
- 眼线是什么意思
- 眼线屁股是什么意思
- 眼线毛是什么意思
- 眼细细是什么意思
- 眼经不如手经,手经不如常舞弄是什么意思
- 眼结合膜及面部皮肤出血点是什么意思
- 眼结构的老年性变化是什么意思
- 眼结膜是什么意思
- 眼结起是什么意思
- 眼绷绷是什么意思
- 眼缘是什么意思
- 眼缬眼碜是什么意思
- 眼罔罔是什么意思
- 眼罩是什么意思
- 眼罩儿是什么意思
- 眼罩子是什么意思
- 眼美儿是什么意思
- 眼翕毛是什么意思
- 眼翻是什么意思
- 眼老儿是什么意思
- 眼耳口鼻舌等器官是什么意思
- 眼-耳廓发育不全是什么意思
- 眼耳毛是什么意思
- 眼耳鼻口是什么意思
- 眼耳鼻咽喉应用解剖彩色图谱是什么意思
- 眼耳鼻咽喉手术麻醉是什么意思
- 眼耳鼻咽喉疾病影像学图鉴是什么意思
- 眼耳鼻咽喉科临床解剖学图谱是什么意思
- 眼耳鼻喉系是什么意思
- 眼耳鼻舌身意(打《三字经》一句)著六官是什么意思
- 眼耳鼻诀是什么意思
- 眼肉胎凡是什么意思
- 眼肌是什么意思
- 眼肌型肌营养不良症是什么意思
- 眼肌型重症肌无力是什么意思
- 眼肌毛是什么意思
- 眼肌疾病是什么意思
- 眼肌瘫痪性偏头痛是什么意思
- 眼肌运动是什么意思
- 眼肌阵挛是什么意思
- 眼肌面积是什么意思
- 眼肚是什么意思
- 眼肚子是什么意思
- 眼肚浮浮是什么意思
- 眼肿肿是什么意思
- 眼肿蒲桃是什么意思
- 眼肿鼻歪是什么意思
- 眼胀是什么意思
- 眼胀胀是什么意思