化学性质活泼,具有强还原性.
1.Na与O2反应:
常温下:

现象:
❶ 浮:钠浮在水面上.(说明Na密度小于水)
❷ 熔:钠熔成一个闪亮小球并在水面上四处游动.(说明反应放热及钠的熔点低)
❸ 鸣:发出嘶嘶的响声,产生气体.
❹ 红:反应后的水溶液使酚酞变红.(说明生成碱性物质)
4.与酸反应:
2Na+2HCl=2NaCl+H2比与水反应更剧烈
注意 Na与酸反应时,首先与溶质酸反应,当酸不足时,剩余的Na再与水反应
5.与盐溶液反应:
2Na+CuSO↓(4+2H2O=Na2SO4+Cu(OH)2H↓(2/p> 注意 Na与盐溶液反应时,首先是Na与溶剂水反应生成NaOH和H↓(2 2NaOH+CuSO↓(4
总反应为:2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2H↓(2/p> 6.与某些有机物反应: 2Na+2C↓(2
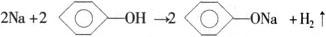
- 大赦天下是什么意思
- 大赦法令是什么意思
- 大赦的消息是什么意思
- 大赫是什么意思
- 大赫尔莫波利斯是什么意思
- 大赫疮疾方是什么意思
- 大走是什么意思
- 大走多跌,大嚼多噎是什么意思
- 大走私犯是什么意思
- 大起是什么意思
- 大起大落是什么意思
- 大起尾巴是什么意思
- 大起灵是什么意思
- 大趁是什么意思
- 大趁银是什么意思
- 大越是什么意思
- 大趋势是什么意思
- 大趔趔是什么意思
- 大趣是什么意思
- 大足是什么意思
- 大足冬尖是什么意思
- 大足千佛岩摩崖造像是什么意思
- 大足县是什么意思
- 大足县志是什么意思
- 大足县旅游局是什么意思
- 大足县(棠香街道)是什么意思
- 大足宝顶旅游商品街是什么意思
- 大足教案是什么意思
- 大足数珠手观音是什么意思
- 大足数珠观音像是什么意思
- 大足數珠觀音像是什么意思
- 大足火车站是什么意思
- 大足石刻是什么意思
- 大足石刻——养鸡女是什么意思
- 大足石刻——并肩耳语是什么意思
- 大足石刻专论是什么意思
- 大足石刻之乡的传说是什么意思
- 大足石刻历史图版是什么意思
- 大足石刻导游手册是什么意思
- 大足石刻的传说是什么意思
- 大足石刻研究是什么意思
- 大足石刻艺术博物馆是什么意思
- 大足石窟是什么意思
- 大足雕刻是什么意思
- 大趴虎儿是什么意思
- 大趸是什么意思
- 大趾是什么意思
- 大趾与二趾相连是什么意思
- 大跃是什么意思
- 大跃步前穿是什么意思
- 大跃进是什么意思
- 大跃进报是什么意思
- 大跃进运动是什么意思
- 大跌了好几盘是什么意思
- 大跌眼睛是什么意思
- 大跌眼镜是什么意思
- 大跑大蹽是什么意思
- 大距是什么意思
- 大跤仓是什么意思
- 大跨度建筑是什么意思