1979年国际原子量委员会规定,一种元素的原子量是“该元素1摩尔质量对核素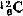 摩尔质量
摩尔质量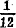 的比值”。原子量是元素的相对原子质量,没有单位。原子量的代表符号是Ar(E),例如Ar(C1)=35.453。由于绝大多数元素都含有同位素,实际上各元素的原子量也是以
的比值”。原子量是元素的相对原子质量,没有单位。原子量的代表符号是Ar(E),例如Ar(C1)=35.453。由于绝大多数元素都含有同位素,实际上各元素的原子量也是以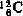 为标准计算所含各同位素的平均相对质量。过去,化学上所用的原子量是以氧的平均同位素量等于16为标度的,1961年改为以碳的最常见的同位素原子质量等于12为标度。新的原子量的数值和旧的化学原子量的数值相差很小。一般旧原子量较新原子量约大百万分之四十三,在应用到四位以上有效数字时才略有差异。例如氧的旧原子量为16.0000,新原子量为15.9994。目前测定原子量多采用质谱计法。
为标准计算所含各同位素的平均相对质量。过去,化学上所用的原子量是以氧的平均同位素量等于16为标度的,1961年改为以碳的最常见的同位素原子质量等于12为标度。新的原子量的数值和旧的化学原子量的数值相差很小。一般旧原子量较新原子量约大百万分之四十三,在应用到四位以上有效数字时才略有差异。例如氧的旧原子量为16.0000,新原子量为15.9994。目前测定原子量多采用质谱计法。
- 中外合资经营项目的注册资本是什么意思
- 中外合资经营项目的财务评价是什么意思
- 中外合资经营项目经济评价是什么意思
- 中外合资财务公司是什么意思
- 中外合资银行是什么意思
- 中外名书奇书1是什么意思
- 中外名书奇书10是什么意思
- 中外名书奇书102是什么意思
- 中外名书奇书103是什么意思
- 中外名书奇书104是什么意思
- 中外名书奇书105是什么意思
- 中外名书奇书106是什么意思
- 中外名书奇书107是什么意思
- 中外名书奇书108是什么意思
- 中外名书奇书109是什么意思
- 中外名书奇书11是什么意思
- 中外名书奇书110是什么意思
- 中外名书奇书111是什么意思
- 中外名书奇书112是什么意思
- 中外名书奇书113是什么意思
- 中外名书奇书114是什么意思
- 中外名书奇书115是什么意思
- 中外名书奇书116是什么意思
- 中外名书奇书117是什么意思
- 中外名书奇书118是什么意思
- 中外名书奇书119是什么意思
- 中外名书奇书12是什么意思
- 中外名书奇书120是什么意思
- 中外名书奇书121是什么意思
- 中外名书奇书122是什么意思
- 中外名书奇书123是什么意思
- 中外名书奇书124是什么意思
- 中外名书奇书125是什么意思
- 中外名书奇书126是什么意思
- 中外名书奇书127是什么意思
- 中外名书奇书128是什么意思
- 中外名书奇书129是什么意思
- 中外名书奇书13是什么意思
- 中外名书奇书130是什么意思
- 中外名书奇书14是什么意思
- 中外名书奇书15是什么意思
- 中外名书奇书16是什么意思
- 中外名书奇书17是什么意思
- 中外名书奇书18是什么意思
- 中外名书奇书19是什么意思
- 中外名书奇书2是什么意思
- 中外名书奇书20是什么意思
- 中外名书奇书21是什么意思
- 中外名书奇书22是什么意思
- 中外名书奇书23是什么意思
- 中外名书奇书24是什么意思
- 中外名书奇书25是什么意思
- 中外名书奇书26是什么意思
- 中外名书奇书27是什么意思
- 中外名书奇书28是什么意思
- 中外名书奇书29是什么意思
- 中外名书奇书3是什么意思
- 中外名书奇书30是什么意思
- 中外名书奇书31是什么意思
- 中外名书奇书32是什么意思