血痕血型测定
对经血痕种属试验确定为含人血的检材所作的血型测定。在刑事犯罪案件中,所遇见的大多为干血痕,此时,血细胞干瘪或变形,甚至许多血型物质已被破坏,故血痕中的血型测定较新鲜血液困难很多,测定技术也不相同,能测定的血型系统也相对减少,血痕越陈旧,能测定的血型就越少。进行血痕血型测定,首先应肯定该血痕为人血,否则将无意义。其次,许多细菌也含有与人类相似的血型物质,而这些细菌常会污染检材,特别是潮湿的血痕,未能及时干燥,细菌则大量繁殖,而干扰了血痕血型的测定。另一方面,实验用的标准红细胞和血清若被细菌污染,可破坏凝集力和效价,又可因细菌本身的酶活性,造成错误的判定结论。此外,有些检材基质,如布的媒染剂或色素,可破坏检验时所加入的标准血清。石灰、粉笔、颜料、特别是锌,都可干扰实验,造成失败。
血痕血型测定
确定检材含有人血后,应作血型测定。血型根据孟德尔遗传规律遗传,终生不变(除极少数白血病或直肠癌患者,病程中见有血型改变),因而血型可供作个人识别。但血型测定的意义主要在于否定,因为在人群中相同血型者很多。如两份检材的血型皆为O型,巧合的机会可高达40%,故不一定是同一人的血。但测定的血型系统越多则越有价值。例如,若两份检材都是B型、M型、cDe0.46×0.029=0.0028,因此可以估计,此两份血痕来自不同一人的巧合机会只有1/357。
在刑事犯罪案件中所遇见的大多为血痕,其中较为新鲜或仍潮湿者,虽可立即用盐水浸出,按新鲜血液检验方法测定血型,但多数检材均是干燥、陈旧或受污染的血痕。此时,血细胞已干瘪或变形,甚至血型物质也已破坏,血型测定的条件十分恶劣,与检验新鲜血液不能相提并论。血痕越陈旧,能测定的血型就越少。能否检出多种血型抗原,还取决于检材中血痕量之多寡。因此,检验时最好先测定血量多的检材(如死者及嫌疑对象)的血型,探讨它们之间的关系,再决定量少而关键性的检材(如嫌疑对象衣服上的点滴血痕)应测定何种血型。例如,死者为O型,嫌疑对象为A型,则应测定衣服上血痕的ABO血型。若死者是A、M型,嫌疑对象是A、N型,则无需测衣服血痕有无A抗原,而可直接测定MN血型。即使如此,仅测定一种血型系统,所需检材仍可能大于上述各种试验(包括预试验、确证试验和种属判定)的总和,故在分配使用检材时,尤其是当血痕量少时,节约前三个试验的检材用量至为重要。
进行血痕的血型测定,应首先肯定该血痕是人血。否则,若是动物血,一则测定血型毫无意义; 二则有的动物血也有与人血类似的血型物质。例如,较高等的灵长类动物(如猩猩、黑猩猩、长臂猴)有与人类A、B类似的血型物质。较低等的灵长类(如猕猴、广鼻猴)则有类似Rh抗原的物质。有一些灵长类还有类M物质,甚至低等动物,狗、猪、山羊、绵羊等的红细胞及唾液中也有A型物质。兔、龟、蛙、大鼠、牛、山羊、猪、狗、猫、土拨鼠的红细胞及几种唾液中含有B型物质。故它们有可能造成混乱。而且,动物相互之间均有与异种红细胞凝集的异种凝集素,这样,许多动物血清可凝集任何血型人的红细胞,而任何人的血清又能与动物红细胞结合。因此,如果未先肯定是人血,而贸然进行血型测定则可造成错误的结论。
其次,许多细菌也含有与人类相似的血型物质,如大肠杆菌O86有类B型物质,肺炎双球菌14型含类A型物质等。而这些细菌经常污染检材,特别是潮湿的血痕,未能及时干燥,则细菌可大量繁殖,以致干扰血型的检验。另一方面,试验用的标准红细胞和血清若不新鲜,被细菌污染,既可破坏其凝集力和效价,又可因细菌本身的酶活性,造成错误的试验结果。如红细胞被棒状杆菌及孤菌等污染后,细菌的神经氨酸酶作用于红细胞膜,将末梢的神经氨酸切断,露出T-受体(末端基β-N-acetyl-D-galactosamine),而具备多凝集性,与所有人(除6个月内的婴儿)的血清发生凝集(因正常人血清都含有抗T凝集素)。同样,血清被细菌污染后,能凝集各型红细胞(全凝集)。有些检材基质(如布)的媒染剂或色素可破坏检验时所加入的标准血清,而使检验失败。此外,石灰、粉笔、颜料、特别是锌白是很坏的基质。
血痕ABO血型测定 在ABO血型系里,红细胞上有凝集原(即A、B、H血型物质),血清中有同种凝集素(即抗A及抗B抗体),故测定ABO血型,可有二种途径:
❶测定凝集原,
❷测定凝集素。两种测定结果互相参照,可使结论更为可靠。除ABO血型外,其他血型系统一般只有抗原,而无天然抗体,故只能测定抗原。
凝集原测定 血痕干燥后,其中红细胞虽已变形或破坏,但A、B、H血型物质是一种多糖体,对干燥和高热有较强的抵抗力和高度耐久性,故能保持与相应抗体特异结合的能力。利用这种特性便可测定血痕的血型。
吸收试验: 当被检血痕分别与已知的抗A、抗B血清充分作用后,凝集素就与血痕中相应抗原相结合,使血清中凝集素大为减少乃至消失(被吸收),该血清再遇已知的相应红细胞则不再出现凝集,或凝集大为减弱。从而可以推断血痕中所含的抗原,以确定血型。此实验称吸收试验又称凝集抑制试验。例如,若抗A抗体被吸收,不再与后加的A型红细胞发生凝集反应,说明血痕中含有相应的A抗原;如抗B抗体被吸收,说明血痕中含有B抗原;如抗A,抗B两者都被吸收,说明血痕中含有A和B两种抗原;如抗A、抗B两者都不减少,说明血痕中不含A和B抗原。这是经典的血痕的血型测定法,比较准确,容易掌握。但所需检材量较多,试验时间较长。
作吸收试验用的抗A和抗B两种抗血清,其效价必须与血痕中所含抗原的量相适应。若所用抗血清的效价过高,则血痕中的凝集原不能将凝集素全部吸收,当加入标准细胞时,仍会出现凝集现象,以致不能发现血痕中的凝集原。若所用血清效价太低,血痕中凝集原固然能将凝集素全部吸收,但血痕所附基质(如血布的布纤维及染料)的非特异吸附的能力,也可能将凝集素全部吸附,这样就难于区别凝集素的吸收是由于血痕还是由于基质所致,一般临试验前要测定血清的效价,并配成16~32倍为宜。指示红细胞必须新鲜(最好是数人红细胞混合,使A和B型凝集力大抵相同),用盐水洗涤1~2次后,配成2%红细胞盐水悬液。
检验时剪取血痕检材(衣服、纸片)两块,每块约1cm2,分别剪碎。同时剪取检材的无血痕部位及已知A、B型血痕作对照。若血痕附着于硬而表面光滑的物体上,则刮下血痂约30mg,均分2份。然后分别放入有标记的试管内,再按标记分别加入抗A、抗B血清各0.2~0.3ml。充分压挤混和,使之浸透。塞好试管后,放温箱2小时,4℃冰箱12~24小时,使凝集原与凝集素充分作用。空白对照的抗A和抗B血清也要同样处理。经吸收后,取上清液测定效价。若空白对照血清效价仍为32倍,而含血检材与不含血检材吸收程度相差3级以上,表示有特异性吸收,即含血检材中有某种凝集原,从而可判断血型(表)。
表中检材Ⅳ对抗A和抗B两种凝集素均未见吸收,即未检见A和B两种抗原,故血痕应系O型。但有时不能排除原来含有的凝集原,因血痕过于陈旧或由于其他原因遭致破坏,以致未能检出血型物质,故应慎重考虑为要,在表中以“O”表示。为进一步确定是否O型,可用凝集素测定法检出抗A和抗B(见下),也可用抗H抗体进行测定,O型红细胞含H抗原最多,故可吸收抗H抗体,经充分吸收后,再用2%O型红细胞测定该抗H抗体效价是否减少,如果与无血检材对比减少3级以上,即证明被检血痕确系O型。
吸收试验的血型判定
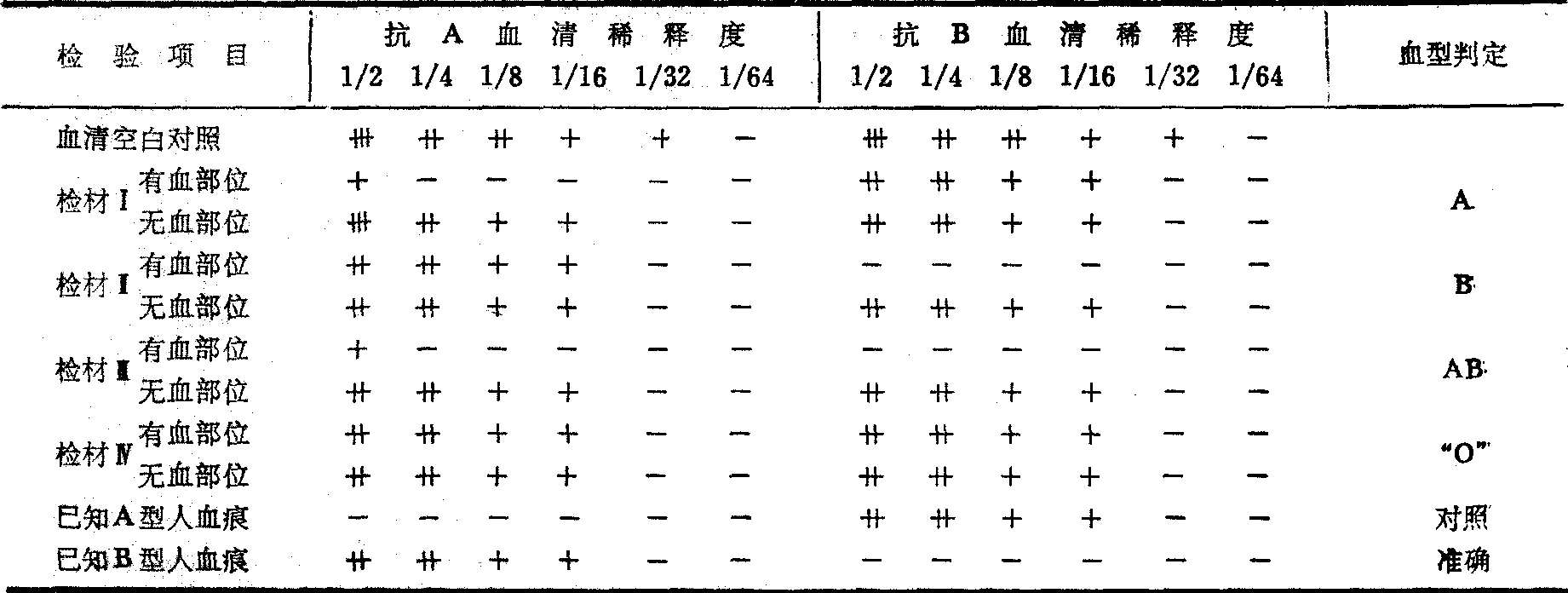
无血痕部位检材的对照(除玻璃等硬物外)十分重要,因有时基质本身具有相当强的非特异性吸收能力。如一例在黑布上的血痕,因黑布的助染剂和染料的非特异吸收能力,经重复浸渍4次才决定该血痕属B型。作无血痕检材的对照试验,有时还可避免分泌型体液污染所造成的干扰。若检材已先被分泌型人的体液(如唾液或汗液)所污染,而后又沾上另一人的血痕,则所检出的血型可能是血痕及体液斑两者的总和,或者体液斑血型掩盖了血痕的血型,如此均可能导致错误的结论。因此,用无血痕部位作对照试验是每个检验必不可少的重要步骤。
吸收试验应注意
❶抗血清的选择。过去常选用O型人血清,因操作方法略为简单,又可减少检材用量,但当吸收O型血清中的一种凝集素时,另一种凝集素也同时减少,即发生抗体的物理性吸收。因此使用抗A、抗B血清分别浸泡检材为佳,虽然检材用量多一倍,但所得结果比较准确。
❷检材用量。检材中血液含量往往很难估计,因血痕干燥程度不等,基质的性质、厚薄和潮湿程度也不一,故难以准确地测知血液重量。理论上,检材越多越好,但实际上条件十分恶劣,故必须降低抗血清的效价和用量来弥补。
❸标准红细胞。每逢检验必须使用新鲜配制的红细胞悬液,以免细菌污染而发生假阳性反应。吸收前后测定用的红细胞悬液必须是在同一时间从相同人采取的混合血液,以免凝集力有所差异。悬液的浓度应视血清的量及效价而定,不宜过浓,以免引起凝集阻止现象。
解离试验: 在适当温度下,一种抗体可被红细胞的相应抗原所吸附。这种特异性结合在一定条件 (如55℃)下又可解离而释放抗体,故再用相应抗原检查解离液中有无抗体,就可知道相应抗原存在与否,从而也可判断血痕的血型。由于抗体先被抗原吸附,经加热后又解离,故此试验又称吸附解离试验。
此试验的优点是
❶灵敏度高,节省检材,可检出1.5μg的血痕。特别适用于微量血痕的血型测定。
❷节省时间,熟练者在半天内可重复数次而得出较可靠的结论。
❸设备简单。但此试验的技术操作要求较高,稍有疏忽,即有可能出差错,有条件时必须重复2~3次,结果都一致,才能作结论。
解离试验由60年代开始应用于血痕的血型测定,现已广泛采用。解离试验还可作体液斑、分泌液斑、毛发、指甲、骨胳及牙齿的ABO血型测定以及血痕的MN、Rh血型等的测定。同时,在同一纤维,以盐水浸出可溶性蛋白(血清蛋白或血红蛋白)作种属判定后,还可用于解离试验测定血型(因血痕中A,B,H抗原牢固附着于基质,不易被盐水溶解)。
用解离试验测定血痕的ABO血型时,可剪取含人血痕的布纤维二段,各长2mm(若系含血纸片则剪取1mm2二片)。若血痕附于刀刃、玻璃或漆器等硬质表面,则不能直接将血痂刮下作试验(因血痂经血清浸泡,盐水洗涤后可能溶解或破碎,即会影响操作),此时可用蒸馏水浸湿的棉线压在血痕上,使血痕移置于棉线上,干燥后使用。将准备好的检材用甲醇固定5分钟。自然干燥后,分别置于白磁板的两个凹窝内,各加效价为32以上的抗A、抗B血清1~2滴,使布纤维在血清中浸透。再将白磁板放入保湿盒内,置4℃冰箱中0.5~1小时。然后取出纤维,置滤纸上至半干后,分别放入盛冷(4℃)盐水的玻璃容器内,振荡15~20秒钟。再取出纤维,置滤纸上至半干,分别放入试管内,滴加0.1%A型及B型红细胞悬液各1滴,将试管放入55℃(50°~60℃)加热5~10分钟。然后迅速取出试管,离心(1000rpm)1分钟。取出试管,轻加振摇,使沉于管底的红细胞悬浮于盐水内,倾出全部悬液于玻片上。用低倍显微镜检查,见红细胞明显凝集者为阳性反应。试验时必须剪取同等大小的无血痕部分纤维及已知A、B型人血痕同时以同样条件进行对照试验为要。
解离试验也可用以下方法进行,即血痕纤维从固定到冷盐水洗涤的步骤与上法相同。然后将洗涤后的纤维分别放在玻片上,盖上盖玻片,分别滴加相应的0.1%红细胞悬液,将玻片放入保湿盒内,每隔15分钟观察一次,在4小时内,若纤维周围出现红细胞凝集现象即为阳性,如此易于观察,但灵敏度较低。纤维加抗A、抗B血清后,也可移入保湿的真空泵抽气减压装置内,在剩余压7~10mmHg的条件下吸附15分钟,吸附可更完全。
解离试验的结果判断
| 方 法 | 检 材 | 对 照 | ||||||||
| 1 | 2 | 3 | 4 | 无血检材 | A型 | B型 | ||||
| 1 | 2 | 3 | 4 | 人血 | 人血 | |||||
| 加抗A血清后 | ||||||||||
| 加A型红细胞 加抗B血清后 | + | - | + | - | - | - | - | - | + | - |
| 加B型红细胞 | - | + | + | - | - | - | - | - | - | + |
| 血型判断 | A | B | AB | “O” | 对 照 准 确 | |||||
当对照试验完全准确时,含血检材的试验结果才有意义。但有时阳性对照血痕的基质与检材不同,仍有可能造成错误的结论。如检材是旧粗棉纱手套,而对照是细布,前者纤维粗,吸附性强,后者纤维细,吸附性弱。此时若剪取同样长短,则两者所吸附的抗体量不一,故最好以相同质量的纤维作对照为宜。
混合凝集反应: 抗原与抗体发生特异性结合后,再加相应的红细胞时,抗体又同红细胞结合,结果是:血痕-抗体-红细胞三者的结合,在显微镜下可见红细胞附着于血痕基质上。本法灵敏度极高,可检出一条附有血痕的微细纤维或单一细胞的血型。本法具体操作上有许多变法:
(1) 试法Ⅰ: 剪取血痕及无血检材纤维0.2cm各二份,放入白磁板凹窝内,加纯甲醇固定5分钟,干后加1滴0.2%醋酸溶液,用组织针分离纤维,使溶血脱色,10~20秒钟后,用吸管吸去醋酸,以盐水洗3次。分别放入白磁板凹窝内(或放在玻片上用1%鸡蛋白固定)。按标记各加2滴抗A,抗B血清(效价256以上),置保湿盒内,室温静置1小时,冰箱2小时。然后吸去抗血清,用冷盐水洗3次。再分别滴加5~10%相应红细胞5滴,置保湿盒内,放入冰箱中30分钟。滴加盐水,用小镊子夹住纤维,小心漂洗,然后移置于有1滴盐水的玻片上,加上盖玻片(如系固定于玻片者,此时将玻片反转,架在装满生理盐水的烧杯上,使红细胞悬液接触盐水面,游离的红细胞便逐渐沉入盐水内。数分钟后,取出玻片,盖上盖玻片)。最后镜检,纤维周围有红细胞附着者为阳性。此法对棉纱、丝、化纤、纸及木片上血痕均可得满意结果。对组织切片,以及经染色的切片,均仍可检出血型。
据研究(赤石英等,1965),本法可测出红细胞250pg。血痕经过水洗,已无血红蛋白或血浆,而只剩少量红细胞基质时,预试验、确证试验和种属鉴别试验均为阴性,本法仍呈阳性反应 (稀释血痕的阳性极限: 联苯胺1/12,800,血色原结晶1/30,显微沉淀反应1/6400,纤维素板法1/25,600,本法1/25,600)。对经过63年的陈旧血痕及110年的木乃伊组织仍呈阳性,已经腐败2个月的血痕也呈阳性,故认为红细胞基质及血型物质颇能耐受腐败作用。
(2) 试法Ⅱ: 将检材粘附于指纹胶纸上,将胶纸分成两半,各贴在一块贴有双面胶纸的玻片上,使检材朝上,分别加抗A、抗B血清,然后将玻片放入盛有冷盐水的染色缸内,洗去多余抗血清。再加相应的2%红细胞悬液使之结合,将玻片翻转接触于冷盐水面,使游离的红细胞自行分离,然后取出玻片,镜检,阳性时可见红细胞粘连于检材上。若抗A、抗B均呈阴性则用抗H试剂检验是否O型。
指纹因有汗液所含蛋白质及脂肪,故用指纹纸采取后,用茚三酮(ninhydrin)显色,干燥后,照相。然后将胶纸分成两份,各用抗A、抗B血清浸渍5分钟后,洗去多余抗血清,将胶纸贴在玻片或平皿上,加0.2~0.5%相应红细胞,数分钟后,轻摇玻片或平皿,若红细胞附于指纹线上。呈指纹线样图案,是为阳性。反应完成后,放入纯酒精中固定、脱水,作永久性标本。本法整个过程只需30分钟。
对于唾液及精液斑,几万倍稀释后仍可判定血型。皮垢、毛发及毛发表面的汗液斑也可以用本法检出。由于本法灵敏度极高,所以对检材的选择及处理要充分注意防止外来体液的污染。
(3) 试法Ⅲ: 将几根血痕纤维用甲醇固定后,置于白磁板凹内,分别加抗A、抗B血清,经充分吸附后,取出纤维,分别置于二支试管内,加冷盐水用离心沉淀洗去多余血清,再各加1滴A、B型红细胞悬液(0.25%),低速离心(1000rpm),稍振摇后将纤维置于玻片上镜检。阳性者在纤维上见有红细胞附着。
若为精斑、唾液斑或阴道分泌液等,则不需要固定,用盐水浸泡,离心沉淀,取沉淀物进行上述检验。阳性者在细胞(精子或上皮细胞)上见有红细胞附着。
胶乳颗粒凝集试验: 先使胶乳 (如聚苯乙烯或聚乙烯甲苯胶乳)颗粒与抗体分子结合。即将抗血清用硫酸胺沉淀后,透析除去硫酸胺,加碳酸——重碳酸盐缓冲液使pH8.5,得粗制的丙种球蛋白。然后加10%胶乳颗粒悬液(聚乙烯甲苯,颗粒直径2μm),37℃ 1小时,用磁力搅拌,离心(14,000rpm)5分钟,去掉上清液,用缓冲盐水洗涤3次,再混悬于缓冲盐水,离心(1500rpm)5分钟,弃去沉淀,取上清液备用。试验时,血痕纤维用0.2%醋酸脱色溶血后,移入试管,加0.2~0.5ml胶乳悬液,离心(1000rpm)5分钟,取出纤维,用缓冲盐水洗涤,以除去游离胶乳颗粒,将纤维置于玻片上,放大200倍镜检,在纤维周围附着胶乳颗粒者为阳性,试验全过程为10分钟。
标记抗体法: 是检查抗原存在与否极其有力的方法,已引入法医学物证检验领域的有荧光抗体法、铁蛋白抗体法、同位素标记抗体法以及酶标记抗体法等。其基本原理是标记物质(如异硫氰荧光素、铁蛋白、131碘、过氧化酶等)能结合到抗体球蛋白上(直接法与血型抗体结合,间接法与兔抗人免疫球蛋白,或羊抗兔免疫球蛋白结合)而不影响抗体与抗原的特异性结合。然后在特殊装置下,借助标记物质的显现,观察是否含有相应抗原(直接法)或抗原抗体复合物(间接法)从而判断检材的血型。标记抗体法在不同程度上提高了鉴识灵敏度或准确性,并可作抗原定位或作永久性标本保存。除血痕外,还可测定唾液、精液、阴道液、汗液等的血型。但由于需要特殊仪器和试剂,或则实验操作繁杂,费时较久,在法医实践上尚未广泛应用。
凝集素的测定 凝集素是一种球蛋白,较之凝集原脆弱,易受温度(65~70℃即破坏)、湿度、阳光曝晒、腐败及时间等影响而破坏。据实验,室内装在信封内保存的血痕,凝集素能测出的时间,最长者31个月,最短者1周;而在室外的血痕,经日光曝晒或露水淋湿,一天后凝集素即破坏殆尽。陈旧血痕的凝集素大抵已消失,不能测得。但对某一检材血痕,并不能预言能否测出凝集素。一般检材,尽量应作凝集素测定,并应尽速进行,以便既测出凝集原,又测出凝集素,两者结果相符,判定更为正确。特别是O型,因原来缺乏A和B抗原,抗原测定阴性结果,难于判断是O型还是由于A和B抗原都已破坏所致,但若测出抗A及抗B抗体,即可确定属O型。
玻片法: 剪取0.2×0.2cm大小的血痕检材三块,分别置于标明A、B、O的三块玻片上,若系血痂,则用小刀刮下大小0.1×0.1cm的完整薄痂三块,分别置于玻片上,盖上盖玻片,按标记滴加0.2%A、B、O红细胞悬液于各盖玻片下,使红细胞悬液弥散整个盖玻片,然后将玻片放入保湿盒内,置室温中,每5~10分钟用低倍镜观察1次,如半小时尚未凝集,以后则每半小时观察1次,直至发生凝集或红细胞变形为止(一般经4小时未见凝集,即不能再发生凝集)。由于血痕蛋白质(凝集素及血红蛋白等)逐渐溶解于盐水,使血痕周缘的胶体浓度逐渐增高驱赶红细胞向外周移动。因此,在血痕周围形成一个空白带,随着时间推移,空白带逐渐增宽。若血痕中凝集素能凝集红细胞,首先发生于空白带外围。故观察时先把检材置于视野中央,然后移动玻片,沿着空白带周围观察有无凝集现象。若不能确定是凝集或假凝集时 (因红细胞过度集中、堆积),可用针头或玻璃棒轻压盖玻片,若系真凝集,则红细胞团块成堆移动,若系假凝集,则红细胞分散移动。试验应有对照,即剪取无血痕检材及已知A、B型人血痕,同样处理。结果判断如表:
凝集素测定应注意
❶凝集素检查,仅呈阳性结果才有意义,如在O型红细胞不凝集的情况下,与A、B型两种红细胞的凝集,表示检材中含抗A及抗B两种凝集素。与此同时作凝集原测定未见A及B抗原,则可正确判断为O型。但若与A、B型两种红细胞均不凝集,即不能检出抗A和抗B时,只能推测为“AB”型,尚须经凝集原测定,检见A和B两种凝集原,才可判定为AB型。仅检出抗A或抗B一种抗体,也同样必须与凝集原测定结果相符。如O型血痕,有时可只保留抗A,而抗B消失。这种情况只能认为该血痕不可能是A或AB型,而可能是B或O型尚须结合凝集原的测定,才能正确判定。总之,由于凝集素的脆弱性,凝集素的测定只能作为凝集原测定的辅助检查。
❷检验时,检材不能太厚(尤其是检查血痂时),否则盖玻片与载玻片之间空隙太大,非加多量红细胞悬液不能填满,这样就有发生假阴性或假阳性之可能。同时,纤维或血痂必须整块,不能分散,否则红细胞散落在纤维或血痂碎片之间(而不是在纤维或血痂周围),容易发生假凝集。
❸红细胞必须新鲜,并经过1~2次洗涤。使用一定稀释度(0.1~0.2%)方能适应血痕中的凝集素量,红细胞悬液太浓或太淡都可不发生凝集(假阴性);洗涤是为清除红细胞悬液中可能存在的游离A或B抗原,否则有可能与检材中的抗A或抗B发生中和,而抑制本应发生的凝集现象。
❹检材的选择: 血痕中凝集素的分布不是均匀的。血液滴在布质纤维上,血清很快向周围渗透,故斑痕边缘所含凝集素较多。若小滴血液滴在硬质物体上,迅速凝固成薄痂,则整个血痂都含凝集素,但若系厚滴血液,则凝固后血痂收缩,挤出血清,在血块内凝集素量往往极少。若血液滴于木质或泥土等吸水性强的物体上,则血清能渗入血痂底下的基质中,血痂内所含凝集素也较少。
测定血痕中凝集素的结果判断
| 检材 | 加A型 红细胞 | 加B型 红细胞 | 加O型 红细胞 | 所检出的 凝集素 | 血型 判断 |
| 检材Ⅰ含血 无血 | + - | - - | - - | 抗A抗体 - | B |
| 检材Ⅱ含血 无血 | - - | + - | - - | 抗B抗体 - | A |
| 检材Ⅲ含血 无血 | + - | + - | - - | 抗A和抗B抗体 - | O |
| 检材Ⅳ含血 无血 | - - | - - | - - | - - | “AB” |
| A型人血痕 | - | + | - | 抗B抗体 | 对照 |
| B型人血痕 | + | - | - | 抗A抗体 | 正确 |
若上述方法不成功,而检材量较多时,可考虑试管法进行凝集素测定:
试管法: 取适量检材,剪细后置试管内,加少量盐水浸泡,再用玻棒挤压,使挤出暗红色液体,然后又让检材吸收液体,如此反复数次,置冰箱12~24小时后,离心,将上清液平分三支试管内,分别加1滴0.1%A、B、O型红细胞悬滴,充分混匀后,将试管置于冰箱内5分钟,然后离心(1000rpm)1分钟,使红细胞沉淀,迅速弃去上清液,向各管滴加盐水1滴,然后振摇试管,肉眼及低倍镜观察凝集反应。
若凝集素含量过少,则可将浸液滴在玻片三处,晾干后,再滴加,使全部浸液浓缩为三滴,再用A、B、O型红细胞测定。
血痕MN血型测定 当两份检材检验结果ABO血型相同时,便要进行MN血型测定。MN血型抗原也位于红细胞基质上,对热及干燥也有相当抵抗力(100℃加热或经过6个月的血痕仍可检出)。M和N抗原虽较A、B、H血型物质脆弱,但新鲜血痕仍能准确测定血型。正常人血清中一般无抗M、抗N抗体,因此,MN血型的鉴定只有M、N抗原的测定,其方法基本上同ABO血型,即吸收试验和解离试验。
吸收试验: 制备标准血清可用OM及ON型人红细胞分别免疫家兔,所得免疫血清经稀释并分别用ABN及ABM型红细胞吸收后,用倍量稀释法测定效价,若抗M效价达32倍,抗N效价达16倍以上,便可应用。
检验时剪取含血检材1×1cm两块,剪细,分别置入二支试管内,按标记分别加入效价16倍的抗M、抗N血清,所加抗血清的量以浸透检材后尚剩4滴为度,充分混匀后,塞住管口,置温箱2小时,冰箱12~24小时使其充分吸收。经吸收后,离心沉淀,然后分别用1%OM、ON型人红细胞测定效价。
试验时,应同时剪取无血痕检材和已知M、N型血痕作对照,若含血检材与对照无血检材吸收相差3级以上,而其他对照都成立,便可测知有无M、N抗原。
血痕中MN抗原吸收试验结果
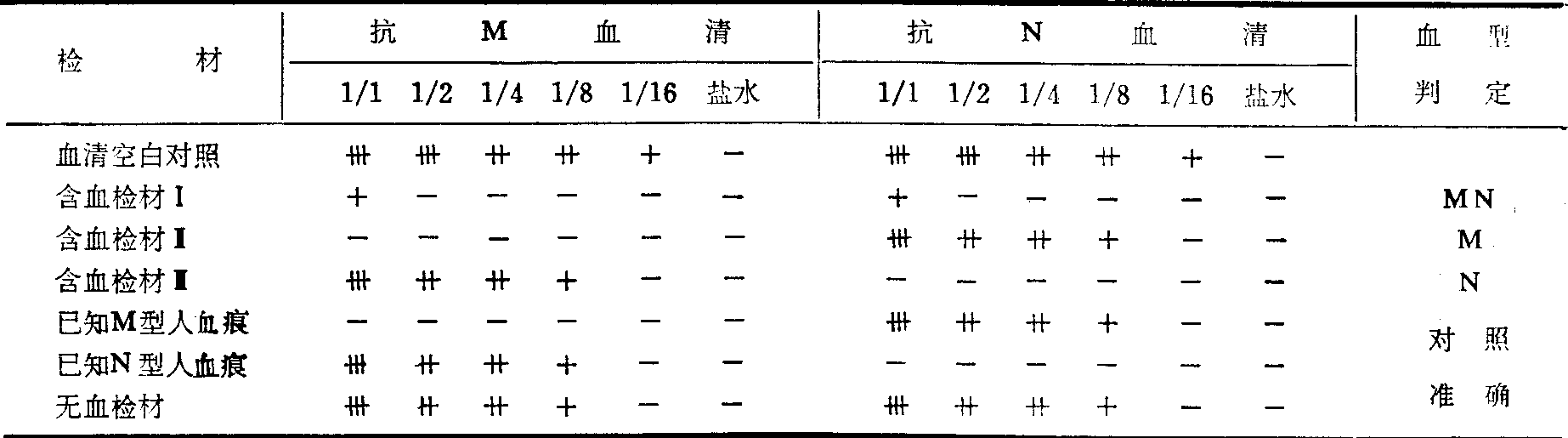
二期吸收法: 由于M抗原能非特异地部分吸收抗N血清,故可能将M型血痕误为MN型; 又MN型中的N抗原有时含量甚少,故又可能将MN型误为M型,因此常需作二期吸收法测定。方法是将第一次浸泡过的检材各加生理盐水1ml,充分混匀后,高速离心10~15分钟,吸干其上清液。再在第一次加抗M血清的试管中加抗N血清,在原加抗N血清的试管中加抗M血清,各0.3ml,充分混匀后,温箱2小时,冰箱24小时。然后如第一期吸收进行操作和观察、记录。
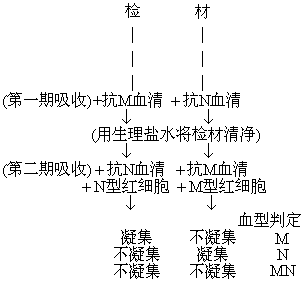
解离试验: 方法同ABO血型的解离试验。
结果判定如下表。
测定MN血型所用的抗血清是免疫家兔血清,抗M、抗N抗体常有交叉反应,很难制备高度特异性抗体。因此,常发生假阳性反应,这就要求用冷盐水洗去游离血清的时间要长(具体时间因检材基质及其他条件如室温,浸泡时间等而异)。每逢测定检材之前应先检验已知M、N型血痕及无血检材对照,待掌握具体条件后,再作正式试验为要。由于易出差错,试验技术操作要求较高,故最好每一检材要重复检验2~3次。结果都一致时才能作结论。如果不一致,应同时作吸收试验,以吸收试验为准。
MN血痕解离试验的血型判定
| 检 材 | 所加抗血清 | 所加红细胞 | 凝集 | 血型判定 |
| 已知M型血痕 | 抗M 抗N | M型 N型 | + - | M型 |
| 已知N型血痕 | 抗M 抗N | M型 N型 | - + | N型 |
| 含血检材Ⅰ | 抗M 抗N | M型 N型 | + - | MN型 |
| 含血检材Ⅱ | 抗M 抗N | M型 N型 | + - | M型 |
| 含血检材Ⅲ | 抗M 抗N | M型 N型 | - + | N型 |
| 无血检材 | 抗M 抗N | M型 N型 | - - | 对照准确 |
解离试验的改良法: 现有多种方法用以去除抗M、抗N血清中非特异性抗体,但提纯抗体后,效价显著降低,有时不适于应用。勾板馨(1971)介绍,用解离法合并抗球蛋白试验测定血痕的MN血痕,可将解离抗体的凝集效价提高二级。其原理是解离抗体(兔血清免疫球蛋白)与相应红细胞结合后,若效价不够高,不能发生凝集。此时若再加羊抗兔血清免疫血清,由于该免疫血清与兔血清免疫球蛋白结合,从而使红细胞发生凝集。
检验时,剪取含血纤维二条,每条长1cm,不作固定,用针分离成细纤维,分别置于两支试管内,各加效价8倍的抗M、抗N血清。经充分吸附后,用冷盐水 (4℃以下)10ml洗涤2~3次,最后加2滴盐水。置试管于50~60℃水浴上加热10~20分钟,解离后弃去纤维,各管分别加1滴1%新鲜M、N型红细胞悬液。10分钟后,离心(1000rpm)1分钟,弃去上清液,各管分别加1滴羊抗兔血清(对兔血清沉淀素价8000倍,临用前稀释10倍)。10分钟后,离心(1000rpm)1分钟,观察结果。
经6个月后的M、N、MN型血痕均得明显阳性反应,但未加羊抗兔血清以前则阴性(见表):
新鲜血痕(6个月内)的MN血型检查
| 斑痕血型 | 加羊抗兔血清前 | 加羊抗兔血清后 | ||
| 抗M | 抗N | 抗M | 抗N | |
| M N MN | - - - | - - - | ⫲ - ⫲ | - ⫲ ⫲ |
据该作者报告,经1~2年的陈旧血痕也得阳性结果,但血痕时间越久,凝集反应越弱。可检出的血液最大稀释度和血痕最小需要量分别是:M及N型1:50及26μg;MN型中M抗原1:25~1:50,26~36μg,N抗原1:25,36μg。
血痕Kell血型测定 红细胞的Kell抗原抵抗力也相当强,在血痕中能长久保持,故若有优良的抗血清,一般血痕可测定Kell血型。
测定方法主要用吸收试验: 取检材剪碎,置试管内,加抗K血清(用高效价抗血清稀释成效价8或16倍)数滴,使浸湿检材后能回吸出2滴。置37℃,1小时,其间经常摇动,然后离心。取上清液分置2支试管内,分别加等量2%K+及K-红细胞,37℃,30分钟。然后各管加抗人球蛋白血清1滴,振摇混匀,离心后观察结果。不发生凝集者表示检材含有Kell血型抗原,即为K+型。凝集者表示不含Kell抗原,即为K-型。实验时应同时做无血痕检材,已知K+血痕及K-血痕作对照。
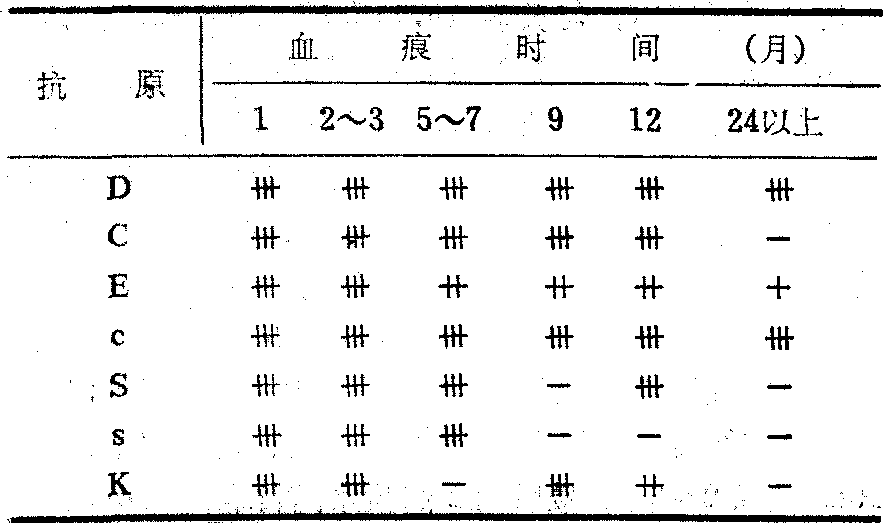
血痕Rh血型测定 Rh的血型抗原远较ABO抗原脆弱,但一般室内数个月的斑痕仍能得出结果,而曝晒于阳光下则Rh活性很快减弱。斑痕中Rh抗原可用吸收试验也可用解离试验测出,与ABO血型不同之点是本血型系统的所有试验都必须于37℃进行。解离后所用指示红细胞先用酶(木瓜酶)处理,然后配成0.1%悬液应用。以解离试验可测出的Rh血型系统抗原有C,c,Cw,D,E,e等。
不同时间的血痕的抗原测定结果
注: “-”未测。
解离试验还可测定S,s,K,Fya,Fyb及JKa等抗原。在室温条件下,保存在信封内的血痕,几种血型抗原检出时间如上表。
有的实验室还应用能作血型抗体定性和定量的自动分析仪,用于解离试验中测定解离液的抗体含量。
血痕血清型测定 斑痕中Gm及Km型的测定: 取抗Gm(各型)、抗Km(各型)血清各稀释成效价8倍。再选用ORh(—)红细胞,用合适的抗D(Rho)血清致敏。
检验时检材用0.1ml盐水浸泡,浸泡离心沉淀后,吸出上清液,加等量抗血清混合,经37℃1小时后再置于4℃冰箱3小时,使充分中和,然后加致敏红细胞,观察有无阻止凝集,而判断型别。例如,血痕能使抗Gm(1)血清与致敏红细胞不起凝集,则血痕为Gm(1)型。据井山德治等(1977),用此法测定Gm(1,2、12)及Km(1)型,经3天的血痕重量3mg,1个月的血痕10mg,均可获得阳性结果而判定型别。
连续测定Gm/Km型及ABO血型: Gm等血清型是可溶性抗原,而血痕中红细胞的A、B、H抗原则难溶解,故为节省检材起见,可在同一纤维先测定Gm等血型,然后再测ABO血型。
据Khalap(1978)介绍,先用抗Gm(1,2)或抗Km血清与血痕纤维孵育(纤维不可先用甲醇固定,否则要破坏Gm、Km),取出纤维,溶液测定Gm、Km型。纤维则浸入1ml冷盐水中5分钟(以去除抗Gm、抗Km血清中可能存在的A、B、H物质),吸去盐水,将纤维再浸于冷蒸馏水中去除多余盐水,吸去水分,再置于52℃3小时固定,然后再分若干部分,用解离试验测定ABO血型。据报告,200例1天至10月血痕均可测出型别。
Gc型: 数星期内的血痕。用免疫电泳可测出Gc型。
Hp型 (触珠蛋白haptoglobin): 聚丙烯酰胺凝胶电泳法,1星期的血痕有80%例,5星期的血痕有60%例可判定Hp型。用淀粉凝胶免疫电泳分析可测定历时3个月血痕的Hp型。
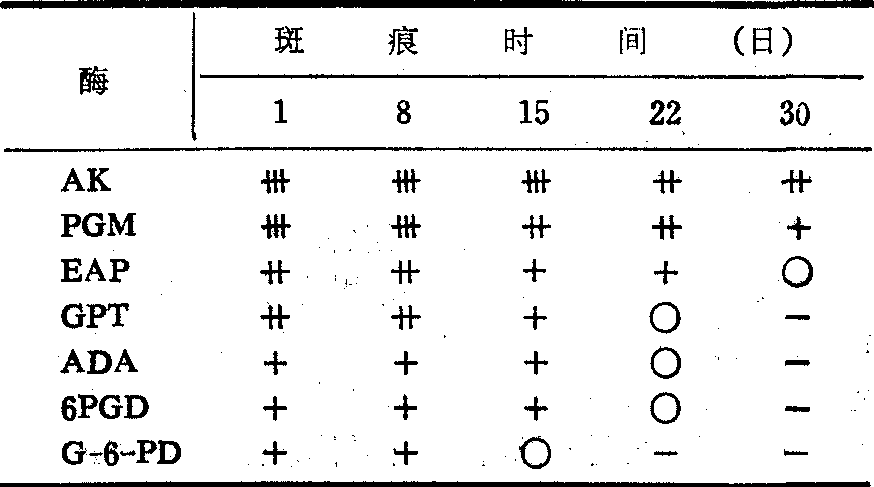
血痕红细胞酶型测定 现已可从血痕中测出PGM,AK,ADA,6-PGD,G-6-PD,EAP,GPT及辅酶D等酶型,所用的方法有淀粉凝胶电泳、聚丙烯酰胺凝胶电泳,包括等电聚焦法等。
斑痕中红细胞酶变性速度见表。
斑痕中红细胞酶变性速度
注:
 很清楚,易定型,卄清楚,易定型; +弱,但仍可定型;○较弱,不能定型;-未测。
很清楚,易定型,卄清楚,易定型; +弱,但仍可定型;○较弱,不能定型;-未测。血痕中异常血红蛋白的测定 刑事犯罪案件中,在血痕中发现异常血红蛋白与血型鉴定有同样意义。检查血痕中异常血红蛋白,要选择未腐败的干燥血痕检材,因细菌会分裂多肽链,致使异常血红蛋白遭受破坏,无法检出。检材量要相当1ml血液。
检验时,用盐水浸出,浓缩后用电泳检验。斑痕越久,图样越不明显。但几周内的斑痕仍可得出结论。对照标本要与检材的条件相似。
血痕中胎儿血红蛋白的测定 在隐匿分娩时测定血痕含胎儿血红蛋白是重要的,3个月以内婴儿的血痕可测出胎儿血红蛋白。一周岁后只留下微痕(小于2%)。胎儿血红蛋白的测定可用:
❶胶质电泳。
❷对碱抵抗性,胎儿血红蛋白对碱变性有较大抵抗性。将血痕浸出液制成1%血红蛋白溶液,加1%氢氧化钾观察从红色变褐色所需时间,用已知成人及胎儿血液作对照。
❸沉淀反应:制备抗胎儿血红蛋白沉淀素血清与检材浸液作沉淀反应,阳性表示检材含胎儿血红蛋白。
❹紫外线吸收曲线:在紫外线下胎儿血红蛋白于288~290nm有一切迹,几个月的斑痕仍可测出,但血红蛋白浓度必须高于10~20%。
脐带血及胎儿血可含50~80%胎儿血红蛋白,在新鲜血痕中之测定并无困难。但分娩时混有相当量母体的成人血红蛋白,故从胎盘流出的血含胎儿血红蛋白只3~30%,有时不易测出。
- 前鼻孔填塞是什么意思
- 前鼻孔闭锁是什么意思
- 前鼻尾韵是什么意思
- 前鼻镜是什么意思
- 前鼻镜检查法是什么意思
- 前鼻音是什么意思
- 前(剪)南 湛露浮尧酒 薰风起舜歌是什么意思
- 前(后)摇绳是什么意思
- 前(日)个是什么意思
- 前(钱)紧是什么意思
- 前𠆧囝是什么意思
- 前𡟓是什么意思
- 前𫐆是什么意思
- 剎是什么意思
- 剏是什么意思
- 剐是什么意思
- 剐刑是什么意思
- 剐剐捞捞是什么意思
- 剐剐牛是什么意思
- 剐割是什么意思
- 剐吃是什么意思
- 剐开口子是什么意思
- 剐擦是什么意思
- 剐毒是什么意思
- 剐油是什么意思
- 剐油儿是什么意思
- 剐王莽是什么意思
- 剐皮是什么意思
- 剐皮肉是什么意思
- 剐腮是什么意思
- 剐草是什么意思
- 剐菜是什么意思
- 剐落是什么意思
- 剐衣服是什么意思
- 剐骨肉是什么意思
- 剐鬼皮是什么意思
- 剐黄麻是什么意思
- 剐(寡)嘴是什么意思
- 剑是什么意思
- 剑一人敌是什么意思
- 剑三千是什么意思
- 剑下右室流出道长轴观是什么意思
- 剑下右心长轴观是什么意思
- 剑下左室长轴观是什么意思
- 剑下心室波群是什么意思
- 剑下心房两腔长轴观是什么意思
- 剑不试则利钝暗,弓不试则劲挠诬是什么意思
- 剑不诛奸磨亦负,书难济世读何为·是什么意思
- 剑与刀是什么意思
- 剑丹是什么意思
- 剑丹记是什么意思
- 剑乡遗韵:丰城市非物质文化遗产名录图典是什么意思
- 剑买牛是什么意思
- 剑井是什么意思
- 剑亭是什么意思
- 剑人是什么意思
- 剑仙是什么意思
- 剑佩是什么意思
- 剑佩声随玉墀步,衣冠身染御炉香。是什么意思
- 剑侠是什么意思