细胞培养cell culture
在模拟机体内的生理环境中,维持细胞生长、繁殖的技术。培养的材料是组织则称组织培养; 培养材料是器官原基、器官的一部分或整个器官,并保持器官原有的结构和功能则称器官培养。一般将细胞培养称无结构性生长,器官培养称结构性生长。
细胞培养是一项程序复杂、工作环节多、要求条件严格的实验性工作,它需要熟练的操作技术,需要制订统一的标准化工作方法,并严格执行,使培养条件在一定时间内保持稳定。
器皿的清洗非常重要,经培养后的各种残留物,如细胞碎屑、代谢产物、蛋白质及其降解产物等都可能对细胞产生毒害,造成培养工作的失败。因此对所有器皿、器械、滤器及胶塞等均需按不同要求分别严格清洗。
防止污染是培养工作的首要条件,必须对经过严格清洗、严密包装的器皿或用具进行严格灭菌以达到无菌。
动植物细胞均需在适宜的温度范围内,才能正常生长繁殖,如哺乳动物细胞一般要求在37~37.5℃;鸡胚细胞38℃; 两栖类细胞25℃; 温水鱼25~30℃; 冷水鱼20℃,果蝇和蚊22~25℃。
细胞在体外生长过程中,必须维持环境pH值的相对衡定,无论是平衡盐溶液、培养基,还是消化用液都必须调至细胞生长的最适pH,如哺乳动物最适pH为7.2~7.4,蛙7.5,鱼7~8,鳞翅目昆虫细胞6.6~6.8之间。用二氧化碳培养箱培养可将培养物置于5%左右的CO2环境中,有利于培养用液pH的稳定。
细胞培养用液 包括平衡盐溶液(BSS)、天然培养基、合成培养基、消化液、pH调整液、抗生素液、细菌培养基和肝素抗凝剂等。配制培养用液的蒸馏水常用经两次蒸馏的再蒸馏水。
平衡盐溶液 用于洗涤细胞和配制各种细胞培养用液。主要成分为无机盐,有时加葡萄糖。无机盐不几种常用平衡盐溶液(g/l)仅是细胞进行生命活动所必需,且在维持渗透压、缓冲性和调节溶液的酸碱度方面也起重要作用; 葡萄糖作为细胞代谢所需能量来源。各种平衡盐溶液的成分差别不大,主要区别在于缓冲系统(见表)。Earle's BSS液及Hanks液最为常用,后者缓冲能力较弱,须用NaHCO3调节pH; Earle液含较高浓度的NaHCO3,缓冲能力较强,须用5%二氧化碳平衡。配制消化液和特殊用途的洗涤液时则宜选用钙、镁离于含量较低的Dulbecco液和无钙、镁离子的D-Hanks液。平衡液中常加入少量酚红作为指示剂,以便观察培养液的pH变化。
| 成分 名称 | Ringer | Tyrode | Earle | Hanks | Dulbecco | D-Hanks |
| NaCl KCl CaCl2 MgCl2·6H2O | 9.00 0.42 0.25 | 8.00 0.20 0.20 0.10 | 6.80 0.40 0.20 | 8.00 0.40 0.14 | 8.00 0.20 0.10 0.10 | 8.00 0.40 |
| MgSO4·7H2O | 0.20 | 0.20 | ||||
| Na2HPO4·H2O | 0.06 | 1.42 | 0.06 | |||
| Na2HPO4·2H2O | 0.05 | 0.14 | 0.02 | |||
| KH2PO4 | 0.06 | 0.06 | ||||
| NaHCO3 葡萄糖 | 1.00 1.00 | 2.20 1.00 | 0.35 1.00 | 0.35 | ||
| 酚 红 | 0.02 | 0.02 | 0.02 | 0.02 |
引自鄂征:《细胞培养技术》,第56页。
天然培养基 包括血浆、鼠尾胶原、体液、淋巴液、胚胎或组织浸出液、血清等。血浆中最常用的是鸡血浆,它具有一定的营养,与少量鸡胚浸出液混合后可以很好地凝固,有利于支持细胞的生长。血清种类很多,以胎牛血清最理想。目前多采用小牛血清,其中含有丰富的营养物质,可供动物细胞生长繁殖之需,且能中和某些有毒物质的毒性,是细胞培养工作中使用量最大的一种。血清代用品有聚乙烯吡咯烷酮、蛋白胨、水解乳蛋白等。有人将水解乳蛋白制备成简单培养液与合成培养液混用,以节省血清用量。
合成培养基 用多种氨基酸、维生素、盐类、葡萄糖和其他生长因子配制而成,如摩根(Morgan)设计的199培养基含60多种成分。在这些成分中,氨基酸是维持氮平衡和合成蛋白质的基本物质,其中13种氨基酸是必需氨基酸,另外还适当加入一些非必需氨基酸。由于细胞需要谷氨酰胺合成核酸和蛋白质,如缺乏将导致细胞生长不良甚至死亡,故培养液中一般含较大量的谷氨酰胺。维生素是维持细胞生长所必需的一种活性物质,在细胞内大多形成酶的辅基或辅酶,如缺乏将对细胞代谢产生重大影响。葡萄糖是细胞生命活动的能量来源,也是合成蛋白质和核酸所需要的重要原料。有时在培养液中还加入其他糖类物质,如核糖,脱氧核糖等。无机盐是参与细胞代谢活动及构成细胞组成部分的重要物质,为保持细胞生长繁殖所必需,它们必需包括平衡盐溶液中的成分以及Fe2+、Zn2+、Cu2+等一些微量元素离子。
各种合成培养基虽然都由上述几类物质组成,但在配方上千差万别,它们都是为适应细胞培养的不同要求而设计的,如Earle基础培养基BME含13种L-氨基酸、9种维生素以及无机盐和血清等,用于鼠及人细胞的培养;后加入高浓度的必需氨基酸而成MEM,可维持较长时间不换液; 以后在MEM基础上增加维生素、氨基酸和非必需氨基酸及硝酸铁以专用于培养仓鼠细胞增殖多瘤病毒。RPMI1640最初是针对淋巴细胞而设计的一种培养基。而CMRL培养基能在无血清条件下维持细胞的生长。
在合成培养基中常加入胎牛血清或新生小牛血清,主要是利用其中含有的血清白蛋白及α-球蛋白两种成分,前者能刺激细胞的生长; 后者能促进细胞贴壁伸展及拮抗胰蛋白酶活力、保证经胰蛋白酶消化后的细胞正常生长。血清在使用前必须经检测,确保没有杂菌或枝原体污染。有的血清对细胞有毒性,可进行细胞毒性试验以丢弃有毒性的血清,或将数头牛的血清混用以中和毒性。又由于血清成分复杂,会影响一些实验中的分析,而人们正在积极探索不需血清的无血清培养基。
消化液 用于分离、分散组织及细胞。可分酶消化和非酶消化两种: 酶消化液常用胰蛋白酶,其作用是催化精氨酸或赖氨酸的羧基及其他氨基酸的氨基间肽的水解, 使细胞分散。 其他如链霉蛋白酶、 胶原酶、透明质酸酶、木瓜蛋白酶等亦可用于消化。非酶消化主要用EDTA溶液,这是一种化学螯合剂,对细胞有一定解离作用,毒性小,使用方便。其他非酶法如玻璃柱吸附分离B细胞组分,利用专一性化合物进行细胞的分层分离,如用尼龙纤维分离淋巴细胞等。
方法 细胞培养根据组织种类、培养目的及条件不同而异。
原代培养与传代培养 从机体取出细胞、组织或器官,进行体外培养,在初次传代之前称原代培养。原代培养的细胞生长到一定密度后,从原瓶取下,分装入一个以上的培养瓶中后称传代培养。
贴壁培养与悬浮培养 接种后的细胞固着于瓶壁增殖称贴壁培养,接种后的细胞悬浮在培养基中生长增殖称悬浮培养。大多数细胞适合于用贴壁培养,但有些细胞适合于用悬浮培养,如长期培养的淋巴细胞,较多种的昆虫细胞等。
转鼓培养 把细胞接种入中性硬质试管中,试管插入恒温箱内的转鼓上,每分钟转动10~20转,使细胞交替地接触培养基和空气,此法十分有利于细胞的生长。
连体细胞培养 两种细胞培养于相互连接的两个培养管中,以研究细胞间的相互作用的方法。其装置是两个特殊的短试管,用一分支管或其他结构将它们连接起来,中间隔以微孔薄膜,培养液可由一管进入另一管,两试管分别接种两种细胞,进行静止培养或旋转培养。通过观察或细胞计数可以了解细胞间的相互作用。有的细胞在体外生长相当困难,为建立这种细胞的细胞系,常在这一装置的一个管中接种生长良好的同物种细胞作为饲养细胞,另一管中接种需要培养的细胞,饲养细胞所产生的物质有助于另一种细胞的生长,从而达到培养另一种细胞的目的。
微载体培养 在贴壁培养时加入适宜的固体粒子,使之悬浮在培养基中,贴壁细胞能借这些微粒表面生长,使培养物不仅具有贴壁培养的特点,能用于原代培养及二倍体细胞的培养; 又有悬浮培养的特点,使之较贴壁培养更能控制温度、pH、CO2及O2等因素,而且由于大大扩大了表面积而可大量繁殖细胞。故此法有较多的优越性,所用固体微粒须有适宜的直径、无毒、易被细胞所贴附,以DEAE-Sephadex A50较为理想。
应用 20世纪下半叶,随着分子生物学崛起,细胞培养已被广泛应用于与生物科学有关的各个领域。在基因工程和细胞工程研究中,真核细胞的基因转移、染色体导入、细胞融合、细胞拆合、杂交瘤和单克隆抗体技术,以至基因疫苗的生产都将细胞培养作为基本实验途径; 在细胞生物学,体外观察到了细胞的生长、繁殖、分裂、分化和运动、吞噬等过程,以及正常和肿瘤细胞的各种差别,大大增加了人类对生命本质的认识; 在病毒学领域,各种细胞系以及各种条件下的培养细胞为病毒学研究提供了丰富的实验材料。细胞培养是病毒的分离、抗原制备,病毒特性的了解和鉴定的重要途径; 在医学遗传学,细胞培养为某些遗传性疾病的诊断和治疗,胎儿产前健康诊断提供了有效途径; 在环境科学,利用细胞培养可以研究环境化学污染对人畜的影响,以及放射性污染对生物体的损伤。近年来,植物的组织培养取得了飞速进展,使植物的育种工作以及人类对生物体的认识提高到了一个全新的高度。
细胞培养cell culture
在模拟机体内的生理环境中,维持细胞生长、繁殖的技术。培养的材料是组织则称组织培养;培养材料是器官原基、器官的一部分或整个器官,并保持器官原有结构和功能则称器官培养。一般将细胞培养称无结构性生长;器官培养称结构生长。细胞培养根据组织种类、培养目的及条件不同又有原代培养与传代培养、贴壁培养与悬浮培养、转鼓培养、连体细胞培养和微载体培养等名称。20世纪下半叶,随着分子生物学崛起,细胞培养已被广泛应用于细胞生物学、病毒学、医学遗传学、环境科学以及基因工程和细胞工程研究中,如在真核细胞的基因转移、染色体导入、细胞融合、细胞拆合、杂交瘤和单克隆抗体技术以至于基因疫苗的生产都将细胞培养作为基本实验途径。
细胞培养cell culture
系指用人工方法在体外培养生活细胞而言。方法是在无菌条件下,将生物的生活细胞与机体分离,移植在含有该细胞所需要营养成分的培养基中,在适宜的温度、湿度等条件的温箱中培养,从中观察生活细胞的生长、繁殖、分化及动力学变化等。细胞培养已广用于细胞免疫学、细胞生物化学、肿瘤细胞学及临床药物学研究等。
细胞培养
细胞培养即细胞在体外培养,通常也称为组织培养,实际亦包括了器官培养。细胞培养作为一种研究活细胞和活组织的最好方法,这种方法是从动物(包括人) 或植物机体(包括胚和种子)内取出器官、组织或经处理分散的细胞置于盛有模拟机体体液环境的培养基或营养液的容器中,置一定的温度孵育,使器官组织或细胞在离体情况下生存、生长和繁殖,并可允许组织和器官分化及维持其结构和功能。如培养物是单个细胞或细胞群体称为细胞培养;如是组织碎块或器官的一部分,则为组织培养; 如是器官原基或整个器官叫器官培养。
细胞培养技术 细胞培养技术主要有以下一些方面:培养材料的获取;细胞的分散;培养的方法; 各类污染的防止;培养基的挑选和适宜酸碱度(pH)的控制; 以及培养温度的选择等。
培养的材料 迄今几乎各类动植物机体的各器官系统的细胞,包括植物的愈伤组织均可进行培养。一般从胚胎或幼体来的材料较成体的易培养成功。
细胞的分散 有机械的、酶的和化学的方法,采用何种方法需视取材而定。
(1) 机械方法: 用于机械分散细胞的器械应当锋利。此法常在组织块或肿瘤和淋巴细胞等的获取以及大多数器官或组织在用酶消化分散为细胞之前采用。
(2) 酶方法: 常用于分散动物细胞的酶有多种,它们的作用机制也各不相同,故在应用时结合取材类型选择使用。现简介如下:
❶胰蛋白酶:是最常用的,它优先催化水解多肽链中与精氨酸和赖氨酸相邻的氨基酸肽链,即凡含上述二种氨基酸之一的蛋白质均可被此酶所消化。此酶也具酰胺酶和脂酶的作用。
❷木瓜蛋白酶:是一种能水解许多肽链和脂键的蛋白酶,可用于分散成体的骨胳肌等。
❸胶原酶:在接近生理的pH时,对自然的胶原特别有效,常用于从富含结缔组织的器官中分散细胞,如可将跟腱胶原水解为链长四或五个氨基酸残余的肽键。
❹弹性蛋白酶:是一种肽链内切酶,可水解中性氨基酸的C末端和脂端的链,能消化结缔组织中的纤维蛋白和弹性蛋白。
❺链霉蛋白酶: 具肽键外切和内切酶活性,可用于分散纤维细胞,而不易分散上皮细胞。
(3) 化学方法 常用于分散细胞的化学物质为螯合剂,它可螯合一些维持细胞彼此间键的牢固的阳离子(如Ca2+、Mg2+和K+等)形成较稳定的络合物,从而使键的牢固性被削弱,使细胞易于分散。常用的钙离子螯合剂有三种形式的乙(甲)烯二胺四乙酸钠(EDTA),其中含四钠形式的商品名称为维尔烯(Versene)。它常与胰蛋白酶结合使用以改善多种细胞的分散作用。含钾离子的螯合剂有四苯基硼,能用于分散成年鼠的肝、肾和脑等。螯合剂也有用于灌注器官(如肝)以获单个细胞悬液。
培养方法 组织或分散的细胞悬液的培养方法多种多样,通常是让其附着在各种固体材料或半固体的表面进行静置培养或旋转培养。有的细胞也可悬浮培养。悬浮培养时,为使细胞不至沉落于容器底部,可使用搅拌、摇晃或旋转等方法维持细胞的悬浮状态。上述三类培养形式,由后向前顺序在同样体积容器中后者较前者可繁殖更多的细胞。如欲维持组织或细胞的正常三维空间生长特征,可用纤维素海绵和一种蛋白质制备的泡沫状纤维蛋白等材料进行培养。用于培养细胞和组织的装置可十分简单或非常复杂,如只需短时间培养的培养物可进行悬滴培养; 需维持较长时间的培养物可在各种培养容器(如玻璃、塑料的瓶、管及平皿等)中生长,它们可随时更换新鲜的培养基使培养物继续生长,当细胞铺满培养容器的内壁时还可进行传代培养,由此可几个月、几年甚至无限地维持下去。为提高细胞的产量已经发展了各种方法,除单纯扩大容器体积从而增加细胞附着的内表面外,还有各种形式的多表面细胞增殖装置,如透气性聚四氟乙烯盘管装置以及有许多人造毛细管的毛细管容器等;有的还可结合灌流控制系统以使新旧营养液不断更新,促使细胞更好地生长并可提高细胞的产量。此外,为克服原代细胞、细胞株和多数细胞系不能进行悬浮培养的困难而发展了一种微载体培养方法。此方法的特点是将悬浮培养和单层培养二种系统的优点结合起来,即培养的细胞作为单层附着在某种材料制的微珠上,微珠又靠搅拌等方法悬浮于容器内的培养基中。为在大规模连续培养中维持细胞,发展了更复杂的装置,能周期性的收获细胞和连续地供应新鲜营养和气体,并不断地自动调整营养液的酸碱度、氧与二氧化碳的分压。用于植物的器官、组织或细胞培养的装置则相对较简单,它们通常是在试管或三角烧瓶等容器内的半固体培养基中生长,也可在漂浮于培养基上的滤纸表面生长,同样,植物细胞也可进行悬浮培养。
污染的控制 培养物的污染有多种,最常见的为各类微生物的污染,因为细胞生长的培养基对这些微生物如各种细菌、真菌、胸膜肺炎微生物(简称PPLO)或支原体等也是较好的营养物质。为避免微生物的污染,用于培养的各种器具和溶液(包括培养基)必须严格除菌; 培养的材料从取材处理到细胞悬液的制备等必须在一个十分清洁无菌的环境中操作,这样的条件可用各种消毒剂或紫外光照射处理全部工作环境或结合过滤空气来创造,如超(洁)净工作台是理想的; 同时应警惕操作者本身带来的污染,一般采用穿戴无菌衣帽和消毒双手预防。自加抗生素于培养基中后多少降低了对严格无菌条件的需要。已利用的抗菌素有许多,但对各种污染的微生物的有效性却各自不同,如青霉素与链霉素对真菌无效,而两性霉素B则有效。抗生素的使用浓度应适宜,过低时易诱导产生耐抗生素的污染有机体; 浓度过高时对细胞生长将产生不利影响。由支原体引起的慢性污染在长期培养的细胞株和细胞系中造成不易觉察的污染,当利用这些细胞进行实验时会造成试验结果的不可靠,如在某些病毒学研究中有时用支原体的存在来解释太意外的结果。由慢性病毒污染的例子也已有许多,如腺病毒和疱疹病毒等。被慢性病毒污染的细胞很少有保存的价值了。另一类污染发生在培养细胞之间,无论各细胞株之间或各细胞系之间或株系之间的相互污染,在保存多种细胞株或系的实验室已是屡见不鲜的。
培养基 供体外培养细胞利用的培养基是多种多样的,对不同的培养物应用不同的培养基。
(1) 成分: 早期人们多采用生物性物质作培养基。如血清、血浆、腹水、淋巴液和组织或胚胎抽提物以及用于植物细胞的椰子汁等。由于生物性物质的各种成分不易控制,而促使发展了许多种由化学物质配制的培养基——化学限定培养基。此类培养基在培养动物细胞时大多必须添加一定量的任何种动物的血清,这样的培养基可称为半限定培养基。少数为某种细胞生长而特别设计的化学限定培养基培养细胞时可不必添加血清,称为完全培养基(或无血清培养基)。
所有化学的培养基均是以包含一系列非生物离子和能源的平衡盐液为基础配制的,最常用的有 Hanks液和Earle液等平衡盐液。每种培养基必须包含的成分有:
❶无机盐离子:它们对调节张力和渗透压,对某些酶的活性及一定酸碱度的维持起决定作用。
❷碳水化物: 是体外细胞的主要能源。动物细胞通常利用D-葡萄糖等单糖,植物细胞通常利用蔗糖。
❸含氮化合物:作为细胞的蛋白质和核酸的基本构筑材料。动物细胞最少需12—13种基本的L型氨基酸,D型氨基酸不能被细胞利用。由于植物细胞可以从简单来源合成复杂的含氮化合物,故对培养动物细胞所需的大量氨基酸在植物细胞培养基是不需要的。最简单的氨基酸(如甘氨酸)和非生物的含氮化合物对于植物细胞或组织的生长可提供足够的氮,当然,加入其他氨基酸对植物生长也是有利的。
❹维生素和某些金属离子: 对维持细胞生命活动必需的酶的正常功能是必须的。一般约需八种水溶性维生素和一些金属离子(如铁、铜和锌等)。
❺激素等:某些激素对维持某些细胞的功能有影响或是必要的,尤其在植物细胞培养中,一些生长素和细胞分裂素起着重要的作用。另外,为维持某些细胞的特殊功能,需要的物质还有某些蛋白质、脂溶性维生素和脂肪酸等。
❻气体: 培养的细胞也需一定量气体供细胞呼吸,动物细胞需氧而植物细胞需二氧化碳。
❼水: 是细胞的重要构成成分,又是一切营养物质的溶媒,而一切培养用具和器皿均需经合格的水清洗后方可使用,故水的质量是细胞和组织培养的基础之基础。其质量要求为没有污染的有机物,比电阻值达300—500kΩ/cm以上。
生物性培养基不必补加上述各类物质,因它们基本上具备。而各种化学限定培养基即按这些类物质的不同配比设计而成,化学限定培养基现已是世界性的商品。除生物性与化学限定这二大类培养基外,另一类是来自生物但经加工处理的培养基,如常用的水解乳白蛋白在其溶液中加一定量的血清后适用于各种原代细胞的培养。
化学限定培养基中最常用的有199培养基,是在基础培养基(BME) 基础上发展的最基本培养基(MEM)。McCoy的5A培养基是为培养小鼠肉瘤设计的,在此基础上发展了RPMI系列培养基,是为白血病的骨髓母细胞以及造血细胞的永久培养而修改的,现常用的有RPMI-1640培养基。在BME基础上为悬浮培养而设计了S77培养基。在适于作克隆的F10培养基基础上又设计了F12培养基,用它获得了较高的克隆效率,某些细胞系可达50%; 用它还能将某些原代细胞作克隆培养或分离杂交细胞。从199培养基发展来的CMRL系列培养基和A2培养基可不加血清培养某些细胞。另外一种培养基YELP是由酵母抽提物、MEM的氨基酸和维生素、水解乳白蛋白和胨组成; 补充0.12%甲基纤维素后特别适用于某些细胞的悬浮培养。KLM3培养基适用于在无血清的悬浮培养中增殖适应的细胞,如L-M株鼠成纤维细胞。
在培养动物细胞时,大多数培养基中均需加入一定量的血清,细胞才能生长。血清的作用是多方面的,如营养、解毒(包括抑制抗生素毒性)、抑制胰蛋白酶的活性、恢复细胞的附壁能力,并且提供一些代谢酶、维生素、微量元素和激素等。另一方面也不能忽视血清中具有诱变物质,它被认为是“瓶中恶变”原因之一。故寻找血清的替代物也成为细胞培养工作的一项任务,如曾有人用过牛血清蛋白、聚乙烯吡咯烷酮细菌蛋白胨、α球蛋白和各种激素等,也有人使用甲基纤维素代替血清用于悬浮培养,但此项研究至今未获满意结果。
(2) 酸碱度: 培养细胞时还需注意调节培养基的酸碱度,因各类细胞的生长需不同的酸碱度。培养大多数动物细胞需要轻微的碱性条件,而植物细胞培养时需酸性条件,培养昆虫类细胞也需略偏酸。一般用以维持酸碱度的缓冲系统为碳酸氢盐和磷酸盐,此类系统的维持有赖于维持一定量的CO2通常是将培养容器置含5%CO2增湿的孵箱中或密封容器口来保持,使用缓冲容量较大的有机缓冲剂HEPES代替上述缓冲系统,效果较好。对植物细胞或组织,常用空气中的CO2维持其酸碱度。
细胞克隆技术 为提高利用培养细胞的各种实验的可靠性和可重复性,也为了分离具有某些特性的细胞(如恶性转化或逆转化的细胞),使用在形态上与生理学特性上尽量一致的细胞是理想的,为此发展了克隆技术。自1948年用毛细管法和条件培养基的方法建立了第一个细胞克隆后,细胞克隆的方法已有各种发展。方法虽多,但设计原理为二:
❶将单个细胞及其培养基局限在一个微小环境中,待其经有丝分裂形成细胞集落,再转种传代,最后形成一个克隆的细胞群体。毛细管法、软琼脂铺盖法、琼脂糖或纤维素凝胶中克隆法、石蜡液下的微滴法以及微量培养板法均属此类。
❷利用经射线或丝裂霉素C等方法处理,使细胞分裂能力损坏但保持新陈代谢能力的细胞薄层来培养少量细胞(如10—100/ml),使形成单个细胞的集落,经分离培养发展为细胞群体,称为饲养层法。以上两类克隆方法均与一种“依赖群体的生长因子”有关,这种因子是由体外培养的细胞产生并分泌的一种营养物质,是培养细胞生长所必需的。目前最广泛采用的克隆方法是用平皿或微量培养板加上克隆效率高的培养基(如F10或F12培养基),既方便又易于成功。植物细胞在低密度培养时,为诱导细胞分裂可加入椰子汁和谷氨酰胺等,以代替高密度细胞的“群体效应”。

成纤维样细胞
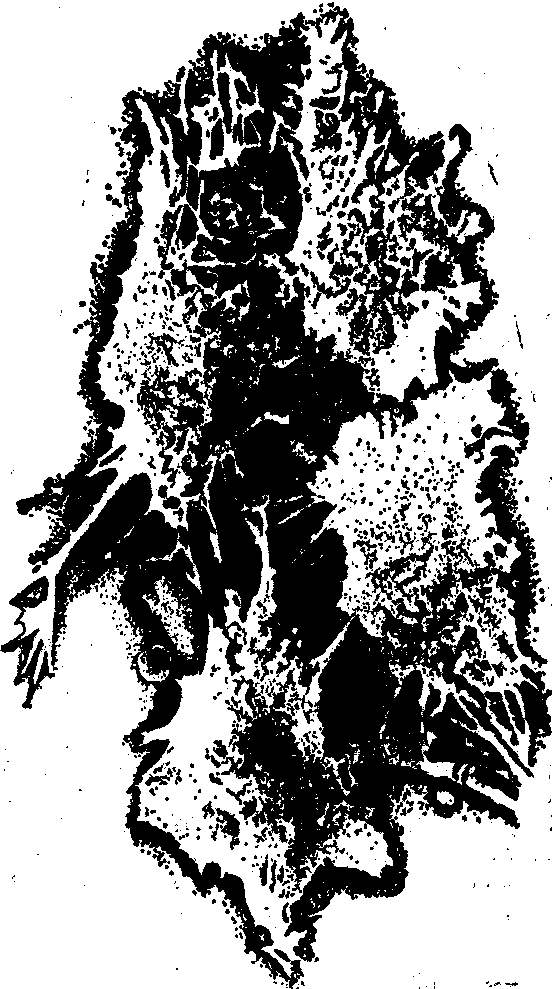
上皮样细胞

圆形细胞
体外培养动物细胞的生长形态
细胞生长与测量 体外培养的动物细胞生长时其形态有趋同倾向,一般可分为三种主要类型:成纤维样、上皮样和圆形细胞(见图)。
细胞生长期 培养的动物细胞有其一定的生长期。依赖贴壁的细胞接种于容器后,开始贴壁和经一短时间的迟滞期;以后开始生长,逐渐进入迅速增殖状态,称对数期或指数期;待细胞增长至相互紧密联接的良好薄层时,出现运动的接触抑制(在一个挤满的培养物中,细胞的生长亦被抑制,即出现细胞有丝分裂的密度依赖抑制),至此,细胞可维持一段时间,称平稳期;最终细胞逐渐衰老、死亡并脱落。如为突变的细胞则可能始终处于生长繁殖状态,可形成小丘状的细胞“微瘤”。培养的原代细胞在形成单层时若进行传代培养即成细胞系。有的细胞系可连续传代而成连续的细胞系,或经选择的方法或经克隆方法而繁殖成细胞株。一个正常核型的人细胞株生长的年代学可概述为: 培养开始的三个月细胞是处在增加速率中生长;其后三个月细胞积极地分裂增殖;然后显出生长速率下降直到大约第十个月左右;此后生长停止,培养物中的细胞退化并死亡。由此可知一个体外培养的人胚细胞在退化前将经历约50±10次传代。据此,从理论上推论一个细胞能培养产生1022个细胞。
测定方法 测定细胞生长状况的方法不少。组织块培养时可测定组织细胞向外生长区域(生长晕)的大小; 对贴壁或悬浮生长的细胞可收获细胞悬液进行直接或间接计数,或计算经离心收集的细胞团的体积,也可采用生物化学方法测定蛋白质和(或)DNA的含量;大量的培养物,尤其植物的培养物可以直接称取干重或湿重;动物器官的培养物用直接测量法是适宜的,如测量骨胳的外植体长度和厚度的增加。而某些组织或细胞的培养物如以其在数量或大小的增加来计算它们的生长速率可能不是一种重要指标,例如来自内分泌腺细胞或器官培养物中特有的激素产物,或一些特殊细胞的抗体产物的产量可以是测定的指标。此外,细胞或器官的分化程度可成为重要指标。有时也可选择细胞功能的能力大小作为指标,如肌细胞的收缩能力,肿瘤细胞导致肿瘤的能力。
细胞的低温保存 细胞能在低于正常培养温度中维持生存。室温(15—25℃)和普通冰箱(±4℃) 常用于短期维持各种哺乳类动物细胞; 30℃时维持存活时间长于37℃; 在20℃或4℃左右细胞更换新培养基所需间隔时间可更长,虽然细胞倾向圆缩或离开瓶壁,然而一旦更换新的培养基并置正常温度后,细胞可很快转为正常生长。长期贮存细胞需非常低温(-70℃以下),使细胞处于冻结状态。液氮是理想的超低温物质,其液相温度达-196℃,在此温度中细胞的一切生物化学反应均停止,几乎可无限期地保存。冷冻保存细胞需非常低温外,还需在浓缩细胞悬液中加入某种冷冻保护因子。早期使用甘油作为冷冻保护因子,稍迟发现二甲基亚砜(DMSO) 对许多种动物细胞更为适宜,它能在细胞内外迅速扩散,代替冷冻过程中细胞失去的水分,使细胞避免发生渗透休克。植物细胞的有效防冷冻物质有氯化钙。细胞的冷冻和复苏过程应当是缓慢冷冻和迅速融化,以避免细胞内形成破坏膜结构的冰晶——将导致细胞的死亡。
细胞培养
cell culture
- 韶光是也,可人的、如今再来。是什么意思
- 韶光流转是什么意思
- 韶光淑气是什么意思
- 韶光荏苒是什么意思
- 韶光遍野是什么意思
- 韶公鸡是什么意思
- 韶关是什么意思
- 韶关中国旅行社是什么意思
- 韶关丹霞山是什么意思
- 韶关国家森林公园是什么意思
- 韶关市是什么意思
- 韶关市旅游局是什么意思
- 韶关市旅游总公司是什么意思
- 韶关市职工旅行社是什么意思
- 韶关市质监所是什么意思
- 韶关市(浈江区)是什么意思
- 韶关族谱家训家规集萃是什么意思
- 韶关的来历是什么意思
- 韶凤是什么意思
- 韶刀是什么意思
- 韶包/俫[le]是什么意思
- 韶华是什么意思
- 韶华不为少年留是什么意思
- 韶华不再是什么意思
- 韶华似水是什么意思
- 韶华如驶是什么意思
- 韶华子是什么意思
- 韶华旅行社(香港)有限公司是什么意思
- 韶华易逝是什么意思
- 韶华淑质是什么意思
- 韶华酒店是什么意思
- 韶卿是什么意思
- 韶和是什么意思
- 韶啦是什么意思
- 韶夏是什么意思
- 韶妙是什么意思
- 韶娘是什么意思
- 韶婆是什么意思
- 韶媚是什么意思
- 韶子是什么意思
- 韶子实是什么意思
- 韶宝是什么意思
- 韶容是什么意思
- 韶山是什么意思
- 韶山4型6400kw8轴货运电力机车是什么意思
- 韶山全家福是什么意思
- 韶山冲毛主席旧居是什么意思
- 韶山冲毛泽东旧居是什么意思
- 韶山型电力机车是什么意思
- 韶山学校是什么意思
- 韶山宾馆一号楼是什么意思
- 韶山市是什么意思
- 韶山市旅游局是什么意思
- 韶山市(清溪镇)是什么意思
- 韶山志是什么意思
- 韶山毛氏宗祠是什么意思
- 韶山毛泽东同志纪念馆是什么意思
- 韶山毛泽东图书馆是什么意思
- 韶山毛泽东故居是什么意思
- 韶山毛鉴公祠是什么意思