分解电压
分解电压fenjie dianya
使某电解质溶液继续不断发生电解所需的最小外加电压称为该电解质的分解电压。例如,用铂电极电解0.5mol·L-1H2SO4溶液(见图(1)),当外加电压逐渐增加时,通过电解池的电流也略有增加。但只有电压增到1.67V(图(2)中的E分)时,电流才随电压迅速上升,同时两极连续不断析出氢气和氧气。1.67V就是电解0.5mol·L-1H2SO4的分解电压,也叫实际分解电压,它大于理论分解电压(1.23V)。
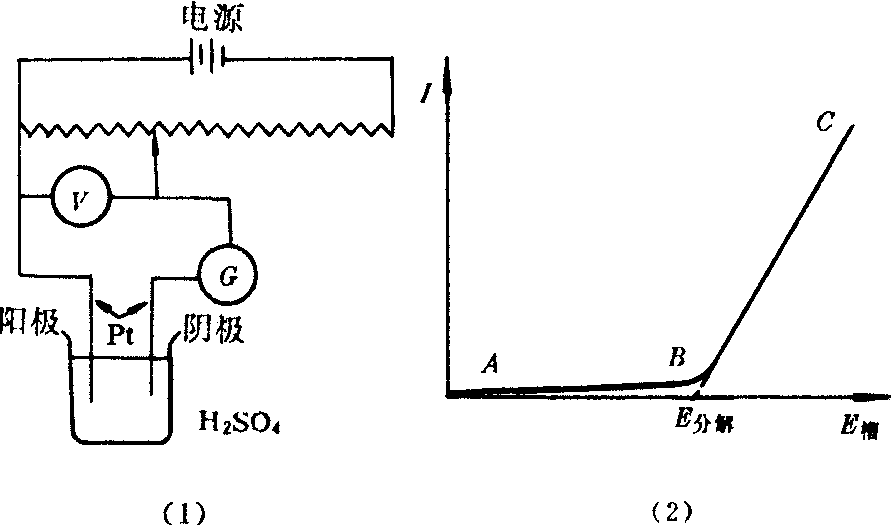
(1)分解电压的测定 (2)测定分解电压时的电流-电压曲线理论分解电压则是电解进行时,由析出物质构成的电池的可逆电动势。例如,电解硫酸溶液时,电解池阴极(负极)析出H2
 电解池阳极(正极)析出O2
电解池阳极(正极)析出O2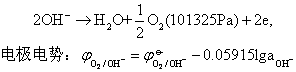 则析出物质(H2和O2)构成的电池的可逆电动势:
则析出物质(H2和O2)构成的电池的可逆电动势:
1.23V就是电解硫酸溶液时的理论分解电压(E理)。一些物质的实际分解电压E实和理论分解电压E理,见表。E实>E理,这是由电解时电极极化造成的。1mol·L-1电解质的分解电压 铂电极
| 电解质(aq) | E实/V | 电解产物 | E理/V |
| HNO3 HClO4 NaOH KOH AgNO3 | 1.69 1.65 1.69 1.67 0.70 | H2, O2 H2, O2 H2, O2 H2, O2 Ag, O2 | 1.23 1.23 1.23 1.23 0.04 |
☚ 金属钝化 电极极化 ☛
分解电压
电解时,使某电解质溶液继续不断发生电解时所必须的最小外加电压,称为该电解质溶液的分解电压。其值视电解质和电极的性质、电解液组成及电解温度等而定。
- 剧场艺术是什么意思
- 剧学月刊是什么意思
- 剩余劳力安置是什么意思
- 剪刀差是什么意思
- 剪刀的寿命是什么意思
- 剪刀股(Ixeris debilis)是什么意思
- 剪切是什么意思
- 剪切机下料是什么意思
- 剪切流动与剪切粘度是什么意思
- 剪床是什么意思
- 剪断是什么意思
- 剪春罗(Lychnis coronata)是什么意思
- 剪板机是什么意思
- 剪灯新话是什么意思
- 剪纸是什么意思
- 剪纸影片是什么意思
- 剪鼻毛法是什么意思
- 副乳腺是什么意思
- 副交感神经是什么意思
- 副产品处理设备是什么意思
- 副产品处理设备是什么意思
- 副产品处理设备是什么意思
- 副刊是什么意思
- 副流感病毒肺炎是什么意思
- 副溶血弧菌食物中毒是什么意思
- 副痘病毒属是什么意思
- 副省级城市地税局的主要职责、内设机构及其分管的工作是什么意思
- 副神经损伤是什么意思
- 副粘病毒属是什么意思
- 副结核病是什么意思
- 副结核病是什么意思
- 副耳整复术是什么意思
- 副载频校频仪是什么意思
- 副醛是什么意思
- 副醛是什么意思
- 副银屑病是什么意思
- 副食品价格补贴是什么意思
- 副食品价格补贴是什么意思
- 副食品价格补贴是什么意思
- 副鼻窦蓄脓是什么意思
- 割台上出现堆积现象是什么意思
- 割嘴到切割工件表面的距离h是什么意思
- 割晒机的主要性能参数和技术规格是什么意思
- 劈、割设备是什么意思
- 力基准机和力标准机是什么意思
- 力学元件是什么意思
- 力学分析法是什么意思
- 力学性能是什么意思
- 力学性能是什么意思
- 力学性能和工艺性能是什么意思
- 力学性能测定是什么意思
- 力学性质是什么意思
- 力学计量的内容和分类是什么意思
- 力学计量的方法和原理是什么意思
- 力的概念、单位及其复现是什么意思
- 劝学篇(汉译世界学术名着丛书)是什么意思
- 劝学篇(汉译世界学术名着丛书)是什么意思
- 办事机构和工作机构是什么意思
- 办公室工作计划管理流程是什么意思
- 办公室节能减排是什么意思