阿仑尼乌斯公式
阿仑尼乌斯公式alunniwusi gongshi
表示反应速率常数与温度关系较准确的经验式。其数学形式为
k=k0e-Ea/RT (1)
式中Ea为实验活化能,或称阿仑尼乌斯活化能; k0是频率因子,又称指前因子。Ea,k0均为经验常数。表示反应速率常数与温度和活化能的定量关系的指数方程式,叫阿仑尼乌斯公式,又称反应速率指数定律。对式(1)取对数,得
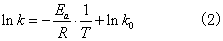
Ink对1/T作图,得一直线,由其斜率和截距可分别求出Ea和k0。理论上证实,Ea和k0均有一定的物理意义。Ea不是同一个分子水平上的能量,而是一种统计平均的能量。对基元反应,实验活化能有明确的物理意义 (参见“活化能”)。对非基元反应,实验活化能亦称表现活化能。因非基元反应不是一步完成的,Ea只反映组成该反应的若干个基元反应活化能的综合效应。温度较低时,Ea可近似为常数。频率因子k0与反应物浓度无关,但与反应物分子的碰撞频率有关。不同反应的k0值不同。
将式 (2) 微分得

此式表明lnk随T的变化率与活化能Ea成正比。活化能越高,则随温度的升高,反应速率增加得越快,
即活化能越高则反应速率对温度越敏感。如果同时存在若干个反应,则高温对活化能高的反应有利,低温对活化能低的反应有利。抑制副反应,就是利用这一道理。
若把式(3)由T1积分到T2,则得
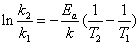
已知两个温度T1,T2下的速率常数K1,K2,代入上式,即可求出实验活化能Ea。若已知Ea和T1下的K1,利用上式可求出任一温度T2下的k2。
若把阿仑尼乌斯公式的指数形式代入化学反应的一般速率表示式,得
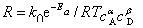
此式体现了反应速率与温度、时间的关系,适用范围不限于恒温,具有更普遍的意义。
☚ 范特荷甫规则 活化能与温度的关系 ☛
- 绿色食品蔬菜的农药使用准则是什么意思
- 绿菜保是什么意思
- 绿菜花灰霉病是什么意思
- 绿菜花菌核病是什么意思
- 绿菜花霜霉病是什么意思
- 绿菜花黑腐病是什么意思
- 绿萝是什么意思
- 绿衣是什么意思
- 绿豆是什么意思
- 绿豆粉是什么意思
- 绿麦隆是什么意思
- 绿麦隆是什么意思
- 绿麦隆是什么意思
- 绿麦隆是什么意思
- 绿麦隆是什么意思
- 绿黄隆是什么意思
- 缁衣是什么意思
- 缄默症是什么意思
- 缅甸1948年土地改革立法是什么意思
- 缅甸1953年土地国有立法是什么意思
- 缅甸1953年土地改革立法是什么意思
- 缅甸1963年土地改革立法是什么意思
- 缅甸1996自然保护立法是什么意思
- 缅甸共产党是什么意思
- 缅甸吸收外资立法是什么意思
- 缅甸土地改革免收立法是什么意思
- 缅甸土地改革分配立法是什么意思
- 缅甸土地改革处罚立法是什么意思
- 缅甸土地改革收回立法是什么意思
- 缅甸土地改革权利立法是什么意思
- 缅甸土地改革规则立法是什么意思
- 缅甸土地改革赔偿立法是什么意思
- 缅甸土地立法是什么意思
- 缅甸土地管理机构立法是什么意思
- 缅甸土改中央机构立法是什么意思
- 缅甸土改县级机构立法是什么意思
- 缅甸土改土地利用立法是什么意思
- 缅甸土改机构权力立法是什么意思
- 缅甸土改理事机构立法是什么意思
- 缅甸战役是什么意思
- 缅甸水资源立法是什么意思
- 缓冲剂、缓冲作用是什么意思
- 缓冲器是什么意思
- 缓冲器与缓冲器距离是什么意思
- 缓冲器用聚丙烯组合物是什么意思
- 缓冲器的安装是什么意思
- 缓冲器距离是什么意思
- 缓冲存货储蓄假定是什么意思
- 缓冲存货储蓄假定是什么意思
- 缓冲存货储蓄假定是什么意思
- 缓冲液的配制是什么意思
- 缓冲溶液是什么意思
- 缓凝剂是什么意思
- 缓和曲线主点元素的计算及测设是什么意思
- 缓和曲线的测设是什么意思
- 缓和曲线的特征及曲线方程是什么意思
- 缓慢性心律失常是什么意思
- 缓慢性心律失常是什么意思
- 缓慢病毒亚科是什么意思
- 缓效性肥料是什么意思