药物制剂的稳定性
药物制剂的稳定性的内容甚为广泛,可从三方面来叙述:
❶化学性: 药物与药物,药物与溶剂、赋形剂、附加剂、容器、杂质以及外界物质(空气、水分等)等发生化学反应而导致药物分解。
❷物理性: 例如乳剂的乳析、分裂,混悬剂中药物的变粗,某些散剂的共熔,晶型的改变,药物的挥发,片剂崩解性能的变化等,都可能使制剂的质量改变甚至不合医药使用要求。一般而言,物理性质的不稳定现象仅是药物物理性质的改变,但药物的化学结构不变。
❸生物性: 由于微生物的繁殖滋长引起药物发霉腐败或分解。
化学稳定性 有些药物由于化学结构上的原因,在另种药物、赋形剂或温度、光线、水分、氧、金属离子等的影响下,可能产生水解、氧化、变旋、聚合等化学反应而分解,结果使药物的原有作用消失、减弱或改变,或副作用增加,个别药物分解后产生有毒物质。这些反应主要发生在溶液中,其中以水解和氧化反应最为常见。了解药物及其制剂的分解反应,可以采取有效措施,延缓或防止其分解,使药物趋于稳定,使制剂安全有效。
分子结构中含有酯或酰胺基团或为甙类药物,易发生水解反应,在氢离子或氢氧离子作用下,反应加速。例如青霉素分子结构中存在β-内酰胺环,很易水解裂环而生成无效物质。巴比妥钠、氯霉素等药物也含有酰胺基团,也比较不稳定。对于这类药物,在制成制剂时,通常采取下列方法以延缓其水解:
❶制成固体制剂如片剂、颗粒剂、胶囊剂、注射用粉末安瓿等。易于水解的药物,对水分敏感,在干燥状态却甚稳定,如青霉素钾(钠)、氯化乙酰胆碱等都可制成干燥的灭菌粉末安瓿,临用时用注射用水溶解。乙酰水杨酸(阿司匹林)常用片剂而不用混悬剂,也是这个缘故。
❷调节溶液pH值于稳定范围:药物的水解速度与溶液的pH值有很大关系,不少药物在某一定pH值范围时比较稳定,例如盐酸普鲁卡因为3.6,硫酸阿托品为3.8,青霉素钠为6.5。常用酸、碱或缓冲剂调节pH值于最稳定范围。
❸选用适当的溶剂:用介电常数较低的溶剂如乙醇、丙二醇、二甲基乙酰胺等部分代替水,常可使水解速度减小。但个别药物例外,如氯霉素在50%丙二醇溶液中的水解速度比水溶液稍快。
❹制成难溶性盐: 溶液中溶解的那部分药物才发生水解,若将药物制成难溶性盐,其稳定性将显著增加。例如青霉素钠(钾)的难溶盐——普鲁卡因青霉素 (水中溶解度1:250),大部分在水中呈混悬状态,比青霉素钠(钾)稳定。苄星青霉素(水中溶解度1: 6000)则更为稳定。
❺低温制备或低温贮藏: 与其他化学反应一样,温度升高水解速度增加。故在制备制剂和贮藏时应避免不必要的加温。对于稳定性差的注射液,在保证完全灭菌的前提下,应避免过高温度或过长时间灭菌或考虑采用过滤灭菌法。
氧化反应也是药物分解的重要原因。酚类、芳香族伯胺类、含有不饱和碳链等的药物,在氧、氧化剂、热、光线、金属离子等的作用下,容易氧化变质,例如盐酸吗啡、盐酸肾上腺素、维生素C、盐酸氯丙嗪、维生素A、油脂等。药物氧化后往往颜色变深,有时并有沉淀形成,个别药物氧化后毒性增加,使用时应十分注意。对于含有易氧化药物的制剂,在设计剂型时应考虑下列几点:
❶加入抗氧剂: 常加焦亚硫酸钠、亚硫酸钠、维生素C、硫脲等,常用浓度为0.1~0.2%。油脂性制剂包括乳剂可用棓酸丙酯、二丁甲苯酚或维生素E等。
❷调节溶液的pH值:易于氧化分解的药物的水溶液,往往在某一定pH值范围内比较稳定。实验证明肾上腺素溶液的pH在4.0时的稳定性比pH6.0时大二倍。通常用酸、碱或缓冲剂调节溶液pH于稳定范围。
❸除去氧气: 制剂尽可能避免与氧(空气)接触,或用惰性气体(如氮或二氧化碳)取代空气。
❹除去金属离子: 铜、铁等金属离子常是药物氧化的催化剂,平常蒸馏水中存在的痕迹金属离子已足够催化某些药物。例如维生素C、盐酸吗啡的氧化。加入适当螯合剂(例如乙二胺四醋酸二钠),与金属离子生成水中可溶但极难离解的螯合物,使金属离子失去催化作用,药物因而趋于稳定。
❺避光:光线可引起某些药物氧化,光线的波长愈短影响愈大,故应避光操作避光贮藏。
大多数左旋光性药物的生理作用较大。有些左旋药物溶液,在氢离子、氢氧离子、催化剂、温度等影响下,可生成生理作用较小的右旋药物。例如左旋肾上腺素收缩血管的作用比右旋肾上腺素约大15倍,当溶液pH小于3或大于6时,就会生成等量的左旋肾上腺素与右旋肾上腺素的混合物(外消旋混合物),收缩血管的作用为左旋肾上腺素的一半多一些。
某些药物可因差向异构(如麦角新碱)、聚合(如甲醛)、脱羧(如对氨基水杨酸)、与二氧化碳化合 (如碱式醋酸铅)等作用而变化。有些药物在一定条件下有多种变化途径,例如pH7以上的肾上腺素溶液,除了氧化外,同时也易于外消旋。pH值偏碱时的盐酸普鲁卡因溶液,在产生水解的同时也发生氧化反应。麦角新碱产生差向异构时可伴随水解和氧化反应。很多药物的分解过程十分复杂,常需采取综合性措施以防止或延缓药物的分解。
物理稳定性 物理性质不稳定对药品质量的影响有时相当明显。例如碘、樟脑、乙醚、乙醇,室温时即可从制剂中挥发逸散。硝酸甘油片剂在贮藏期中可因挥发而减少疗效。水包油型的乳剂型软膏,水分蒸发后形成饼块状,不仅使用不便而且影响疗效。对于这类药剂除了改进处方和制造工艺以外,密封低温贮藏也很重要。混悬剂中微细的药物颗粒,在长期贮藏期间可能变粗而减小其生物利用度,或结块以致用前不易摇匀。在固体制剂或液体制剂中的亚稳态晶型,能缓慢地变为稳态晶型,后者的溶解度和生物利用度往往较小,加入适当表面活性剂或助悬剂可延缓结晶变粗和晶型的转变过程。
生物稳定性 微生物在药剂中繁殖滋长引起发霉腐败,这是普遍现象,往往造成大批成品报废。某些微生物还可使药物的化学结构改变,例如金黄色葡萄球菌和大肠杆菌能产生β-内酰胺酶使头孢噻吩等β-内酰胺抗生素结构中的β-内酰胺环裂开而失去活性。
稳定性的动力学测定 药物分解的速度决定于药物的浓度、温度、pH、催化剂等条件。用化学动力学方法可测定药物分解的速度规律,可预测药物制剂的有效期。药物分解的反应速度常用单位时间内药物浓度的减少或分解产物的增加来表示。药物分解反应速度可用下式:
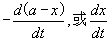
其中a为开始时浓度,x为到t时间分解的量。
反应级数说明反应速度与药物浓度的关系,是由实验求出的数值,有零级反应、一级反应、二级反应等。药物分解的速度,有时用半寿期(t1/2)、百分之十分解期(t10%)表示,分别表示药物分解一半或百分之十所需的时间。t1/2或t10%的数值愈大,表示此药物愈稳定。
零级反应的反应速度与反应物的浓度无关,与反应物的溶解度、反应物对光的吸收(在光化反应中)或催化剂的浓度等因素有关。零级反应的方程式为:
y=kt
其中y为药物在t时的剩余量(用浓度表示),t为时间,k为速度常数。
以药物的剩余量对反应时间作图,结果为一直线,其斜率为k,k即反应速度常数,因此为浓度/时间。例如某药物60℃时的k=0.00082(mol/L·h),意即每小时减少,0.00082mol/L,以恒速进行分解。某些药物的混悬液有时以零级反应进行分解,图1为乙酰水杨酸混悬液分解反应的浓度-时间曲线。
一级反应的反应速度与药物的浓度成正比,方程式是:
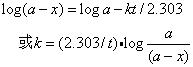
以剩余药物浓度的对数对反应时间作图为一直线,斜率=-k/2.303。k值表示单位时间内药物分解的份数,例如k=0.001/s,意即该药物以每秒0.1%的速度进行分解。下图为哌醋甲酯(Methylphenidate,ritalin)的一级反应图:
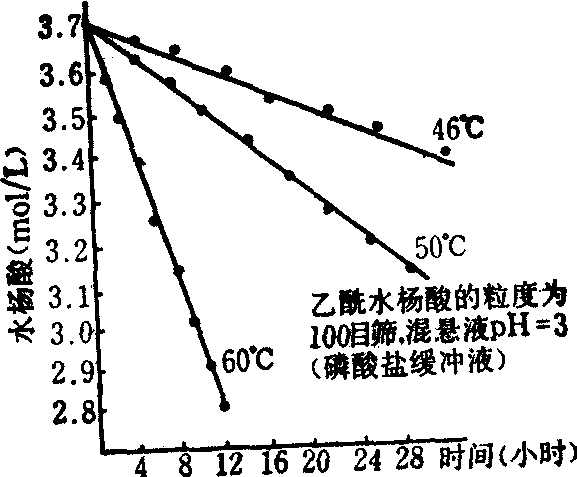
图1 混悬剂中的乙酰水杨酸的分解反应服从
零级反应过程
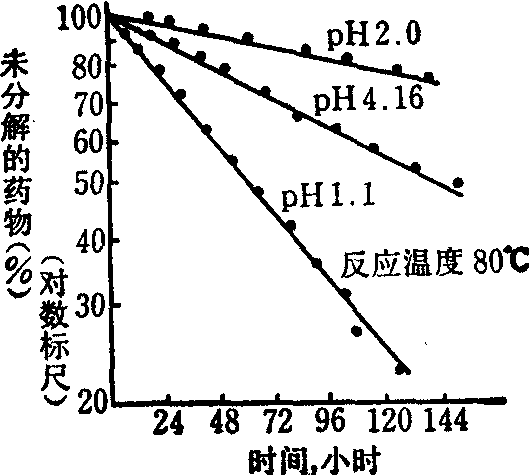
图2 在不同pH时,哌醋甲酯的分解服从
一级反应过程
应用化学动力学的原理,用加速试验(例如恒温加温)方法,可以在较短时间内预测药物的室温有效期。试验方法大致如下: 将药物溶液分别在不同恒温条件下进行分解,间隔一定时间取样,用适当方法测定药物的浓度,以药物浓度对反应时间作图以确定反应级数,求出直线斜率进而算出反应速度常数。取反应速度常数的对数对反应温度(绝对温度)的倒数作图(Arrhenius图),再外推至室温,求出室温时的反应速度常数,由此常数可计算药物在室温时分解一半或分解百分之十所需的时间。
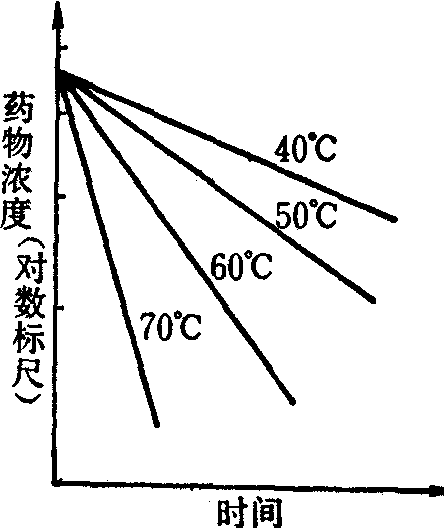
图3 恒温加温条件下,药物的加速分解,服从一级反应过程
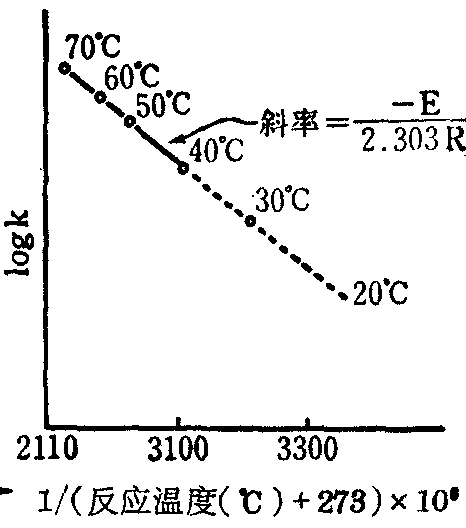
图4 1/(反应温度(℃)+273)
×106预测药物在室温时的稳
定性的Arrhenius图
图4说明温度与反应速度的关系。温度与化学反应速度的关系可用Arrhenius公式表示:
к=Ae-E/RT
即
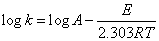
上式中к为反应速度常数,A称为频率因子,E为活化能,R为气体常数(1.987卡/度·克分子),T为绝对温度。logк对1/T作图为直线,
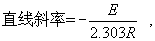 故直线斜率一求出便可求出E,E值大,即发生分解反应所需的能量大,也即该药的稳定性较好;反之,表明药物的稳定性差。例如有一药物,按一级反应过程分解。开始时的浓度为94U/ml。从Arrhenius图中求出常温(25℃)时的反应速度常数为2.09×10-5/h,如该药浓度下降至85U/ml以下时为不合格,该药的有效期计算为:
故直线斜率一求出便可求出E,E值大,即发生分解反应所需的能量大,也即该药的稳定性较好;反之,表明药物的稳定性差。例如有一药物,按一级反应过程分解。开始时的浓度为94U/ml。从Arrhenius图中求出常温(25℃)时的反应速度常数为2.09×10-5/h,如该药浓度下降至85U/ml以下时为不合格,该药的有效期计算为: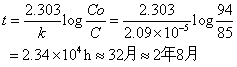
同一药物,在干燥状态或固体剂型中的稳定性要比在水溶液或混悬液中的稳定性大得多,这主要因为前者水分少,水解、氧化等分解反应不易进行。但对有些药物的稳定性仍应注意,例如维生素C、B1、B2、A、青霉素等。水分是固体药物分解的重要因素,对于稳定性差的药物,应严格控制水分含量。上述化学动力学稳定性试验法也可用于固体药物,但准确性和重现性均较差。薄层色谱法、热分析技术、漫反射光谱法、光声光谱法等可用于固体药物或固体制剂中药物稳定性的研究。
- 关山月(1)是什么意思
- 关山月(1)是什么意思
- 关岭布依族苗族自治县是什么意思
- 关市讥而不征是什么意思
- 关市讥而不征是什么意思
- 关心和改善群众的生活是什么意思
- 关心和维护青年利益,密切联系青年群众是什么意思
- 关心群众的思想、工作和生活是什么意思
- 关心职工健康是什么意思
- 关木通是什么意思
- 关税是什么意思
- 关税是什么意思
- 关税与贸易总协定是什么意思
- 关税与贸易总协定是什么意思
- 关税与贸易总协定是什么意思
- 关税及贸易总协定是什么意思
- 关税及贸易总协定是什么意思
- 关税及贸易总协定是什么意思
- 关税及贸易总协定是什么意思
- 关税及贸易总协定与中国是什么意思
- 关税及贸易总协定的内容与原则是什么意思
- 关税及贸易总协定的形成与作用是什么意思
- 关税及贸易总协定的组织与运作是什么意思
- 关税完税价格的审定是什么意思
- 关税应纳税额的计算、缴纳和退补是什么意思
- 关税的减免及审批程序是什么意思
- 关税的纳税人与征税范围是什么意思
- 关税税率的运用是什么意思
- 关系集团是什么意思
- 关系集团是什么意思
- 关系集团是什么意思
- 关联企业间业务往来的税务管理是什么意思
- 关联图是什么意思
- 关节是什么意思
- 关节扭伤是什么意思
- 关节炎是什么意思
- 关节疾病的诊断和评价是什么意思
- 关节的分类是什么意思
- 关节的应用解剖学和生理学是什么意思
- 关节的运动是什么意思
- 关节结核是什么意思
- 关节脱位是什么意思
- 关节退行性病变是什么意思
- 关节透创是什么意思
- 关节镜检查是什么意思
- 关节镜检查是什么意思
- 关贸总协定主持的八轮多边贸易谈判是什么意思
- 关贸总协定在调节国际贸易方面存在哪些局限性?是什么意思
- 关贸总协定存在的局限性是什么意思
- 关贸总协定对国际经济贸易所起的历史作用是什么意思
- 关贸总协定对国际贸易的发展起了什么作用?是什么意思
- 关贸总协定建立的背景与过程是什么意思
- 关贸总协定成立后开展的主要活动是什么意思
- 关贸总协定文本主要包括哪些内容?是什么意思
- 关贸总协定是如何进行日常运作的?是什么意思
- 关贸总协定的发展有哪些特点?是什么意思
- 关贸总协定的地位与原始缔约方是什么意思
- 关贸总协定的基本原则、职能与实施是什么意思
- 关贸总协定的目的与宗旨是什么意思
- 关键业务部门控制的监督评价是什么意思