胶原纤维collagen fiber
又称白纤维。动物体内细胞间纤维之一种。新鲜状态眼观为白色,由数量不等的Ⅰ、Ⅱ、Ⅳ和Ⅴ型胶原蛋白构成原纤维,再集合而成。电镜下原纤维有明暗交替的周期性横纹。光镜下胶原纤维成束状在组织内沿不同方向作波浪样行走,并交织成网,长度不定,粗细不一,苏木精伊红染色着淡红色。是结缔组织中主要纤维。机体内分布广泛,性韧抗拉力强,延伸性差。在形成与再吸收之间保持动态平衡。易被胃液消化,沸水中溶化成白明胶。
胶原纤维jiaoyuanxianwei
主要化学成分是胶原蛋白,是结缔组织纤维的一种。在疏松结缔组织中排列成束,纤维束常有分支。它的化学特性是在酸性溶液中纤维膨胀,可被胃液消化,但不受碱性胰液影响,在沸水中可水解为白明胶。
在电子显微镜下观察,胶原纤维由更细的胶原原纤维组成。通过生物化学和X射线衍射等技术的分析,表明胶原的基本分子单位是原胶原分子。胶原纤维和弹性纤维交织在一起组成了既有韧性、又有弹性,既能使器官与组织抵抗外来牵引力,又能保持形态和位置相对固定的疏松结缔组织。
胶原纤维conagenous fiber
又叫胶质纤维,系疏松结缔组织中数量最多、分布最广的一种纤维。新鲜状态下略呈白色,故亦叫白色纤维,粗细不等,长短不同,走行不一,多呈束状排列,并显有波纹,纤维素常为分枝,彼此交织吻合,亦可形成网状。此纤维特点是韧性大、抗拉力强、柔软易弯曲、略有弹性;在稀盐酸溶液中出现膨胀,易被胃液消化,不受碱性胰液影响,易被伊红染成红色或甲苯胺蓝染成蓝色;在热水中胶原纤维发生收缩,煮沸后可水解成白明胶,其化学成分为一种蛋白质。胶原纤维由成纤维细胞产生,在细胞内生成后,由细胞内小泡载运或直接穿过细胞膜排出细胞外。胶原纤维主要参与构成疏松结缔组织的支架,对保持疏松结缔组织的形态、维持其生理功能等有重要意义。临床上有一大类结缔组织疾病,主要病理表现为胶原纤维中的纤维蛋白变性,这类疾病包括风湿病、类风湿性关节炎、系统性红斑狼疮、硬皮病、结节性多动脉炎等,故研究胶原纤维各种情况及变化等对于探讨某些疾病有意义。
胶原纤维
结缔组织纤维的一种。在体内分布甚广。新鲜时呈白色,故又称白纤维。由许多平行的胶原原纤维粘连而成。电镜下,原纤维有明暗交替的横纹。性韧,抗拉力强,稍具弹性。胶原纤维易被胃液消化,在沸水(或在硝酸)中,溶化成白明胶,具有双屈光性。化学成分为胶原蛋白。
胶原纤维collagen fiber
是结缔组织中的一种主要纤维,由胶原蛋白构成。新鲜时呈白色,故又叫白纤维。在HE染色的切片上呈粉红色。纤维的直径1~2μm不等,往往集聚成粗大的纤维束。每条纤维又由更细的胶原原纤维构成,后者有明暗相间的横纹,横纹的出现周期为64nm。胶原纤维的韧性强,抗拉力大,但弹性差。
胶原纤维
胶原纤维是结缔组织中的一种纤维,主要是由胶原蛋白组成,其基本组成单位是原胶原分子。原胶原分子经多级聚合形成胶原,原胶原分子定向地排列着,在分子间通过共价键交联起来,先聚合成胶原微纤维及胶原小纤维,再聚合为纤维,聚合的顺序如下:
在原胶原分子尚未聚合时,可用中性盐及稀醋酸将其溶解,并提取出来,常称为可溶性胶原,原胶原聚合成为胶原则为不溶性。中性盐能提取出原胶原的α肽链,叫做盐溶性胶原,稀醋酸能提取出原胶原,所以又叫做酸溶性胶原。在ATP的作用下,原胶原分子可再聚集成整齐排列的纤维,在电镜下观察呈片状,每个原胶原分子的方向一致,称为“片状长间隔”,在蛋白多糖的作用下,酸溶性胶原可再组合为平行排列的纤维,但每个原胶原的方向随意,称为“纤维状长间隔”(图1),在天然胶原中,原胶原分子都是四分之一交错排列,有间距为68nm的横纹区带,这是由于原胶原分子形成有规律的四分之一错位排列的结果,(图1、2)。每个原胶原分子的长度约为300nm,相当于4.4D(D≃68nm), 相邻两分子间有0.6D的空隙,并列的原胶原分子相错1D的距离,由于肽链上氨基酸所带电荷不同,通过错位排列便形成电子密度大小不同的区域,出现横纹区带。
原胶原的结构 原胶原分子是由三条α肽链互相缠绕,形成三股螺旋,分子量为3万左右,长达300nm,直径为0.15nm。每条α肽链均为左手螺旋,螺距为0.95nm.相邻两氨基酸的距离为0.29nm。每转一圈有3.3个氨基酸(一般蛋白质的α螺旋中,相邻两氨基酸的距离为0.15nm)。三条α肽链形成的螺旋为右手螺旋,螺距为10.4nm,每个循环转有36个氨基酸。现已发现的原胶原分子至少
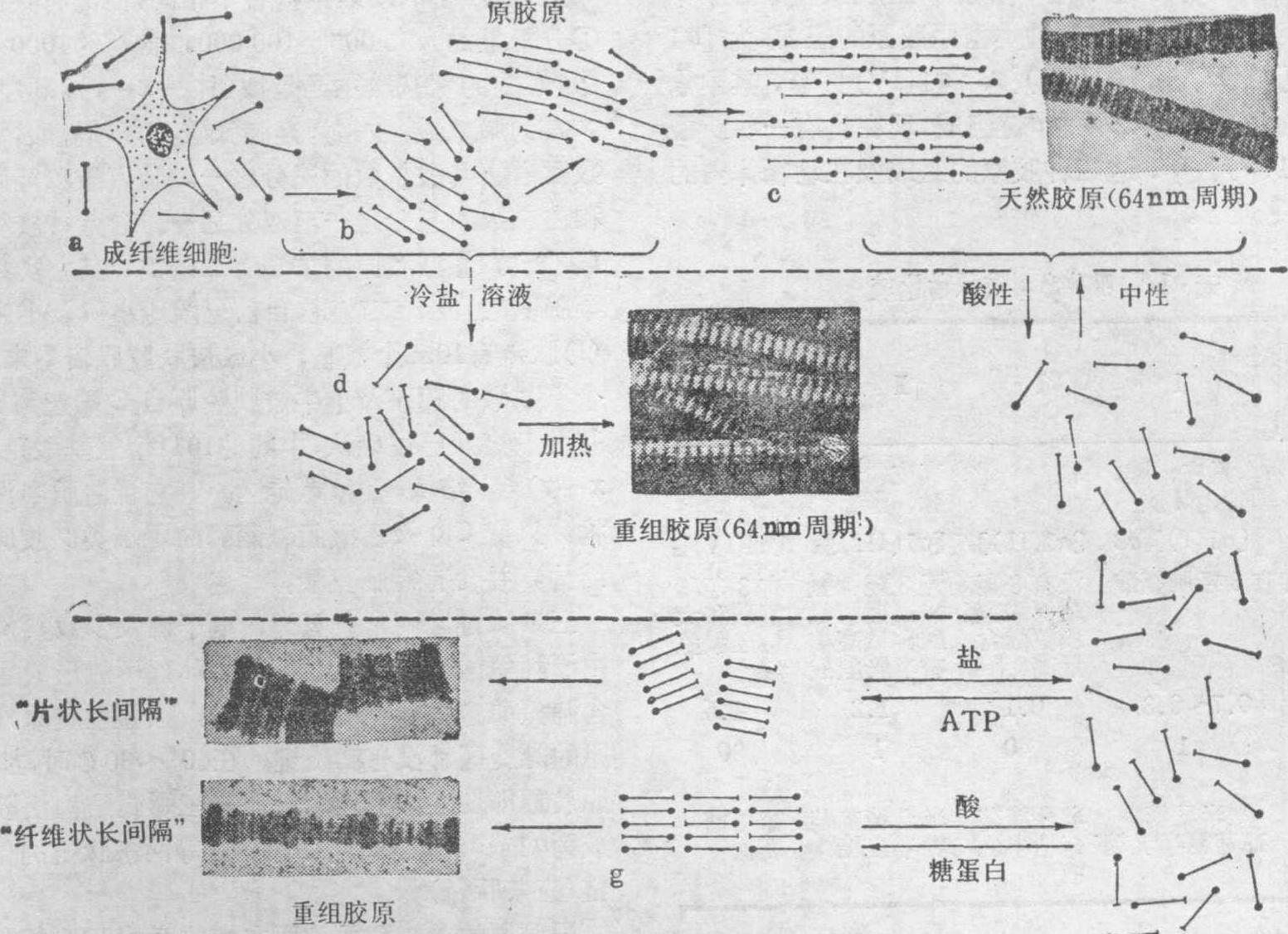
图1原胶原形成胶原纤维的聚集作用。成纤维细胞(a)合成和释放原胶原(b),它在介质里平行线性排列,每一N端和它两边的分子错开约分子长度四分之一(“四分-错开”)(c),产生的纤维表现特性的64~170nm间隔。如果年幼动物的可溶性胶原被溶解,它解聚(d);如果加热就会正常地重排起来。在ATP下,原胶原单位再聚集成完全排齐的样子;在蛋白多糖下,平行股会排齐但方向性随意(g)。在所有的天然胶原中,四分-错开排列才是正常的安排。
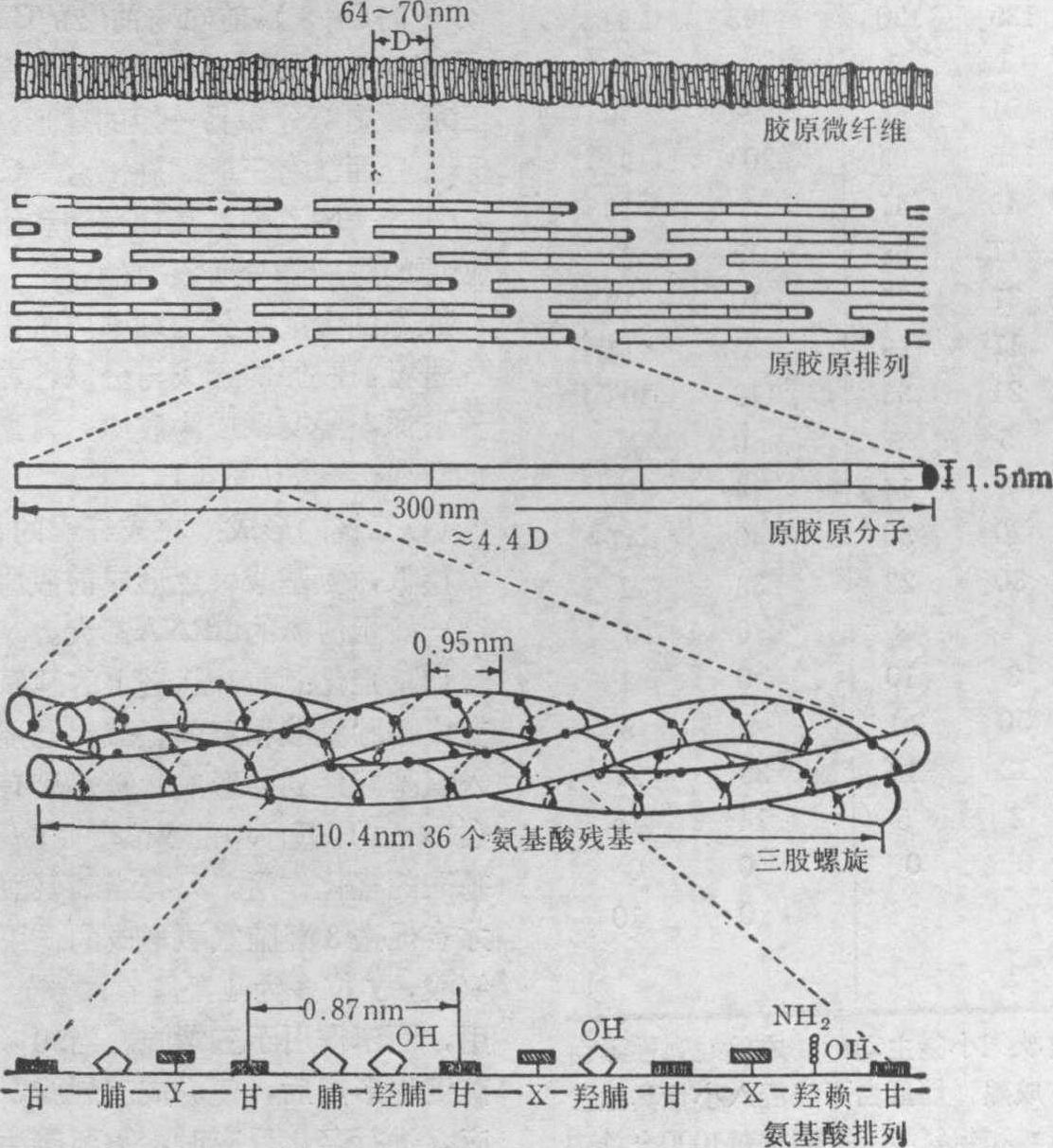
表1 四种类型胶原的比较
| 胶原 类型 性质 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 分 布 | 骨、真皮、腱、 韧带、牙质 | 软 骨 | 真皮、动 脉、子宫 | 基底膜 |
| 组 成 氨基酸组成 特点 | [α1(Ⅰ)]2α2 有3羟脯氨酸 | [α1(Ⅱ)]3 没有3羟 脯氨酸,羟 赖氨酸含 量高 | [α1(Ⅲ)]3 无3羟脯氨 酸,4羟脯氨 酸含量高, 有半胱氨酸 | [α1(Ⅳ)]3 有3羟脯 氨酸和大 量羟赖氨 酸 |
| 羟脯/脯 羟赖氨酸糖 化百分比 | 0.7~0.8 1 | 0.1 40 | 1.2 1 | 1.5 80 |
| 含糖的种类 | 半乳糖 葡萄糖半乳糖 | 半乳糖葡 萄糖半乳 糖 | 半乳糖葡萄 糖半乳糖 | 葡萄糖半 乳糖 |
表2 胶原和弹性蛋白的氨基酸组成
| 氨基酸 | 人类皮肤胶原 | 弹性蛋白* 可溶的,成熟的 | |||
| 总 | a1 | a2 | |||
| 甘氨酸 脯氨酸 3羟脯氨酸 | 330 128 1 | 333 135 1 | 337 120 1 | 287 92 | 269 91 |
| 4羟脯氨酸 丙氨酸 天门冬氨酸 谷氨酸 丝氨酸 苏氨酸 缬氨酸 蛋氨酸 异亮氨酸 亮氨酸 赖氨酸 羟赖氨酸 组氨酸 精氨酸 苯丙氨酸 酪氨酸 半胱氨酸 锁链素 (1/4分子 量计) | 93 110 45 73 36 18 24 6 10 24 27 6 5 51 12 3 0 | 91 115 43 77 37 17 21 5 7 20 30 4 3 50 12 2 0 | 82 105 47 68 35 19 33 5 14 30 22 8 10 51 12 5 0 | 9 203 3 15 10 13 116 0 14 40 38 0 0 4 23 14 0 0 | 10 191 10 21 12 13 103 2 17 47 7 0 1 8 27 15 0 10 |
五种α肽链的一般结构各不相同,但仍有共同点,即 :❶分子量约为95 000至100 000,含有约1000个氨基酸。
❷α螺旋的氨基酸主要是按(甘—x—y)n顺序排列。其中x常为脯氨酸,y常为羟脯氨酸和羟赖氨酸,甘氨酸的数目占氨基酸总数的三分之一。脯氨酸和羟脯氨酸的总和占总数的五分之一至四分之一。含芳香族氨基酸较少(表2)。Ⅲ型胶原的末端有二硫键,其它类型胶原不含半胱氨酸,没有二硫键。目前已阐明小鼠及小牛皮肤中α1(Ⅰ)肽链有1052个氨基,小鼠皮肤胶原自N末端到第567个氨基酸的顺序及小牛皮肤胶原自C端起到第633个氨基酸顺序及已被确认,中间的1011个氨基酸是典型的(甘x—y) 337结构,为α螺旋区。其它蛋白质中没有这种结构,只有C1q及乙酰胆碱酯酶的尾端类似胶原的三螺旋结构,并含有羟脯氨酸。
三条肽链之间常以氢键、电子键及少数共价相交联,由于脯氨酸及羟脯氨酸有吡咯环,不能形成氢键,因此,含脯氨酸愈多则氢键数目越少,除Ⅲ型胶原外,各型胶原的螺旋区都没有二硫键。在40°~60℃时,加热10min,原胶原即变性,变性的胶原其三螺旋结构松散,可分散成为α1或α2单链或β11、β12、β22等两条肽链的聚合物或γ链(三条肽链)。
原胶原的前身即前胶原在螺旋区的两端各有一非螺旋区,称为尾肽或端肽。约有9~25个氨基酸,其氨基酸顺序不是按上述规律排列。在C末端及N末端的端肽中都含有半胱氨酸,所以在端肽部分有二硫键。在C末端的二硫键是在分子间及分子内。在N末端的二硫键只在分子内(图3)。前α1与前α2的C端肽的分子量各为30 000及35 000。在α1链N端的端肽分为三部分,即球形部分、三股螺旋部分和另一短的球形部分。C端的端肽只有球形部分而没有三股螺旋部分。C端肽上还有一些糖,包括两分子N乙酰氨基葡萄糖和十个分子的甘露糖,这是胶原的螺旋部分所没有的。
胶原的合成 分为细胞内阶段及细胞外阶段,在细胞内进行前胶原的合成与分泌,在细胞外,脱去端肽形成原胶原,经交联成为胶原,再聚合成为胶原纤维。胶原的合成步骤如(图4)。
(1)肽链的形成: 在成纤维的粗面内质网上,以mRNA为模板,氨基酸聚合形成前胶原肽链。前胶原的mRNA比一般蛋白质的mRNA都大。
(2) 羟化: 前α肽链上的脯氨酸及赖氨酸均可被羟化变成羟脯氨酸和羟赖氨酸。已羟化的氨基酸不能直接参入氨基酸序列中形成肽链。只有当脯氨酸及赖氨酸位于(甘x—y)n顺序中的y位置时,4羟化酶才促进各该氨基酸的羟化作用。只有当脯氨酸位于x位时,3羟化酶才有促进3羟脯氨酸形成的作用,因此x位多为3羟脯氨酸,y位多为4羟脯氨酸。羟化酶只对单一肽链起作用,而不作用于三螺旋。当90%的脯氨酸被羟化后,二硫键也形成后,便卷成三螺旋,不再继续发生羟化反应。进行羟化反应时,需要维生素C、Fe++、O2及α酮戊
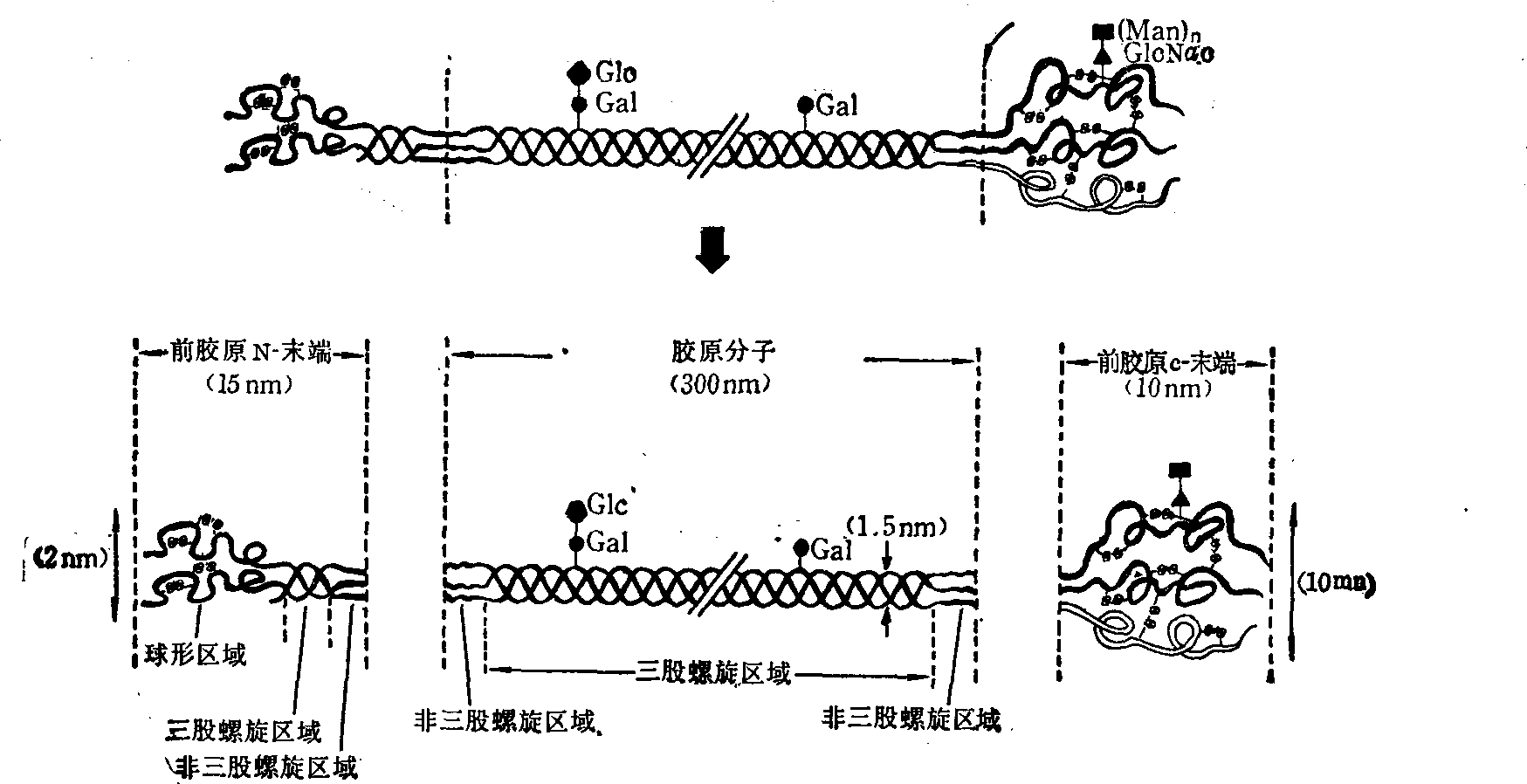
图3 前胶原的分子结构示意图
Man: 甘露糖; Glc: 葡萄糖; Gal: 半乳糖; Glc Nac N乙酰葡萄糖
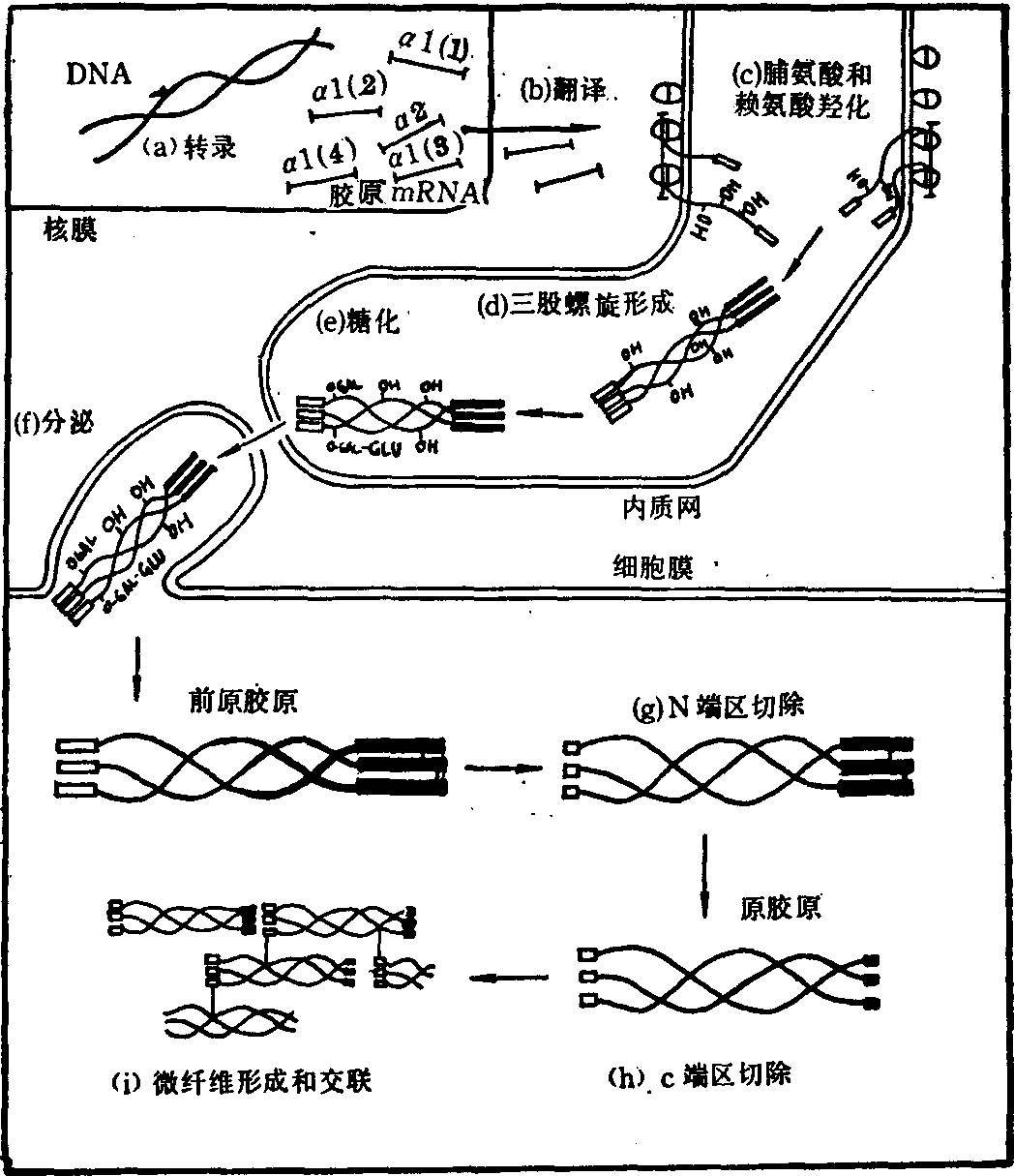
(a)转录 (b) 翻译
(c)脯氨酸和赖氨酸羟化 (d)三股螺旋形成
(e)糖化 (f)分泌
(g) N端区切除 (h) C端区切除
(i)微纤维形成和交联
图4 胶原的生物合成
(3) 糖化: 在前胶原分子中,羟赖氨酸的羟基可与半乳糖及葡萄糖形成糖苷。已发现的胶原中有二磷酸尿苷半乳糖转移酶及二磷酸尿苷葡萄糖转移酶,对羟赖氨酸与糖的结合有特异的催化作用,两种酶都需要Mn++作为辅助因素,其过程如下:
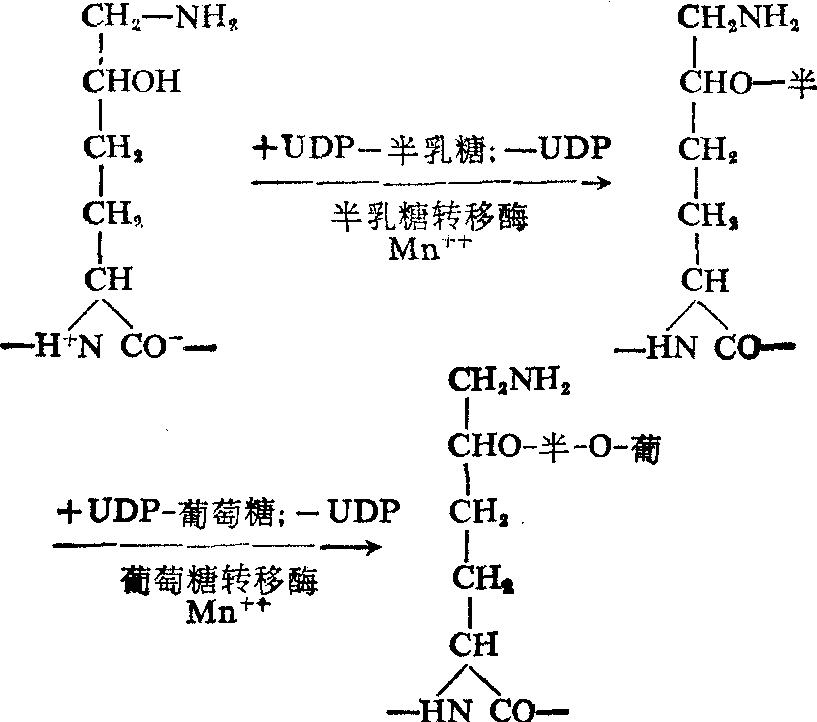
(4) 去端肽: 经羟化及糖化的前胶原肽链就能形成三螺旋,其两端还带有端肽。当前胶原分泌到细胞外时,细胞外的前胶原氨基肽酶及前胶原羧基肽酶能将端肽切去成为原胶原(图4)这两种酶都是糖蛋白,催化反应时需要Ca++,如果先天性地缺乏此酶,以致不能切去端肽,则妨碍交联反应的进行,致使纤维的脆性增强,如牛的皮肤脆性病,就是由于缺乏这种酶而引起。
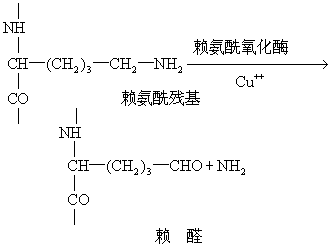
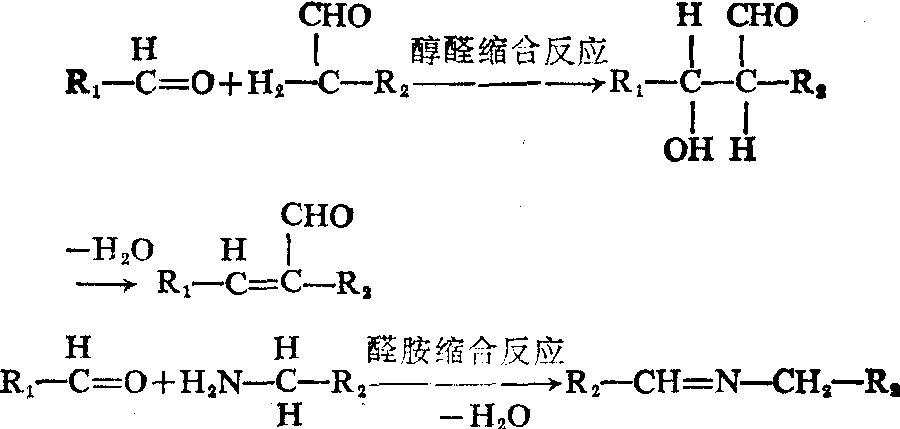
(5) 交联: 细胞外液存在有赖氨酰氧化酶,能催化原胶原分子中的赖氨酰或羟赖氨酰残基,使其ε氨基脱氨变为醛基,此醛基可与另—α肽链的类似醛基进行醇醛缩合反应,也可以通过醛胺缩合反应,使两条肽链之间,形成共价键。这样就能在平行排列的原胶原分子之间形成稳定的共价交联的胶原纤维。这种胶原纤维的韧性很强,可以耐受很大的张力。如果没有交联反应,微纤维就松散,称为胶原松解现象。引起胶原发生松解的药物称为胶原松解剂。Cu++是赖氨酸氧化酶所必需的辅助因素,如缺少Cu++或长期服用青霉胺或β氨基丙腈等(即胶原松解剂),均能影响胶原的交联,发生胶原合成障碍的疾病。如果赖氨酸羟化或糖化反应不能正常进行,也会影响交联反应。Ehrler-Danlos综合征,就是由于这种原因引起的,表现有脊柱侧凸和关节错位。
胶原纤维中共价交联的反应:
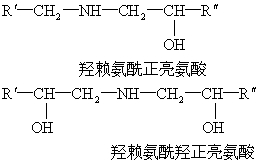
在胶原中发现的交联键有多种,其中有羟赖氨酰正亮氨酸及羟赖氨酰羟正亮氨酸。
这些键可被KHB4还原,叫做可还原的交联键,随着年龄增长,可还原的交联键逐渐减少。成熟的胶原及老年的动物和人体内的胶原中不可还原性的交联键增多,不溶性胶原增多,所以胶原纤维更为稳定。
最近发现胶原中有一种新的交联键,它的分子构造类似锁链素。藤本(1979)命名为吡啶啉。它对热及酸都稳定,有荧光性。
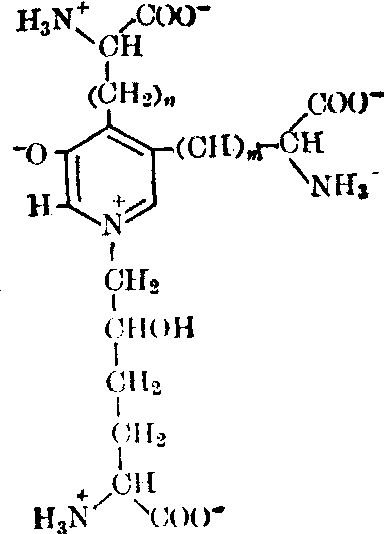 E
EA 胶原在正常组织中常处于动态平衡状况,分解与合成速度都比较缓慢。它在体内降解的地点有三处(图5):
❶在合成胶原的细胞中,一些结构不完善的α链被非特异性蛋白酶分解。
❷在细胞间隙,原胶原以及不溶解的胶原纤维在这里被特异性的胶原酶降解为片段。
❸在巨噬细胞的溶酶体中被吞噬的胶原片段经非特异性蛋白酶分解。
胶原在体内一般不易直接被蛋白酶水解。参加分解胶原的酶大致可以分为两类:
❶是特异性的胶原酶,它能水解原胶原上距氨基末端四分之三处的甘氨酸与亮氨酸之间的肽键,肽键断裂后,便可为各种蛋白酶分解。Ca++是胶原酶的激活剂,血清中α2巨球蛋白能抑制胶原酶的活性,参与调节胶原的分解代谢。胶原酶对温度特别敏感,在36℃时酶活性比30℃时大10倍。
❷是非特异性蛋白酶,只能分解α链及胶原纤维片段。胃酶可以切断羧基末端肽,并打开三股螺旋。胶原在55℃~60℃时变性,变性后可不经胶原酶作用而被各种非特异性蛋白酶水解。
胶原分解后形成寡肽或游离的氨基酸,随尿排出体外,其中羟脯氨酸为胶原中特有的氨基酸,所以测定尿中羟脯氨酸含量可以反映体内胶原的代谢。处于生长期的儿童和青年的羟脯氨酸含量很高。
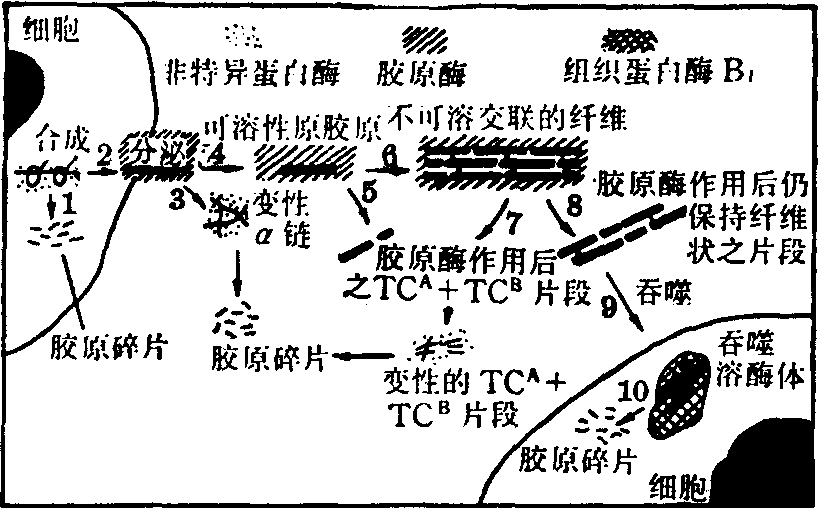
图5 胶原的降解
说明:(1)合成不完善的α链在成纤维细胞内为蛋白酶降解
(2)、(4)分泌到细胞外的原胶原
(6)胶原纤维被特异性胶原酶降解
(3)、(5)、(7)经胶原酶降解的片段发生变性然后为
蛋白酶分解
(10)被吞噬的胶原纤维片段在溶酶体中为蛋白酶分解
胶原的分离提取 常用分离胶原的方法有以下几种:
(1) 在4℃用0.5mol乙酸提取能得到可溶性胶原,再用氯化钠沉淀,变性后通过羧甲基纤维素柱可分离出原胶原的α、β及γ结构。
(2) 用胃酶限制性降解法,胃酶能作用于不溶性胶原的羧基端肽的二硫键,经过羧甲基纤维素柱层析,可得到Ⅰ型与Ⅲ型的α肽链。
(3) 用溴化氢作用于不溶性胶原,它可在蛋氨酸残基处将肽链切断,每种胶原的α肽链约有5至9个蛋氨酸残基,所以能将肽链分解成数个片段。它们的氨基酸顺序,大都已确认。
胶原纤维
胶原纤维是由胶原蛋白构成的一种结缔组织纤维,在体内分布甚广,见于纤维结缔组织、粘液组织、脂肪组织、软骨组织、骨组织。胶原纤维肉眼观呈白色,其抗拉性能甚强,但延伸性差。光镜下,胶原纤维在组织中或向各方作波浪形走行并分支交织成网(如在疏松结缔组织内,参见“疏松结缔组织”条图1),或在组织中成束、成层平行排列(如在肌腱、角膜内)。胶原纤维粗细不一,直径1~20μm,由直径10~100nm的胶原原纤维经少量粘合质粘合而成。胶原原纤维是电镜下显有约64nm周期性横纹的结构单位,这种结构单位有人称胶原微纤维(图1)。胶原纤维是由数量不定的胶原原纤维集合成束的结构,这些原纤维小束彼此之间呈合而复分、分而复合的状态,小束间也常分出原纤维交互联接。

图1 胶原原纤维超微结构并示横纹周期的形成
A. 胶原原纤维负染图,横纹周期68nm×218,400B. 模式图,示胶原蛋白分子按1/4分子长度错开平行聚合成疏密区,N和C代表胶原蛋白分子的两个末端。对比A、B图可见横纹周期与疏密区关系。负染的明暗带的电子密度与正染者相反。
胶原原纤维超微结构的形式 这取决于胶原蛋白分子的聚合状态。胶原蛋白分子是长约300nm、粗约1.5nm的生物大分子,分子量约300,000,由三条α-肽链作三股绳索状互相螺旋盘绕而成,每一肽链约含1050个氨基酸。聚合成胶原原纤维时,平行相邻的胶原蛋白分子向同一方向依次纵向错开约1/4分子长度,而在同一直线上,首尾相随的两个分子彼此保持约43.8nm的距离,由于这两个原因,又导致平行的胶原分子间出现首尾重叠的段落,其长约26.2nm,这样,以胶原蛋白分子为单体,按此方式聚合而成的胶原原纤维,在其内部出现疏(43.8nm)密(26.2nm)区,即为电镜下所见的64~70nm周期性横纹(对比图1A与B)。
胶原蛋白的生物合成 胶原纤维由成纤维细胞、成骨细胞、成软骨细胞和软骨细胞产生。在这些细胞内,胶原蛋白的特定基因经转录及翻译之后,便在粗面内质网处把氨基酸装配成相应的多肽链,后者在内质网腔内形成三股螺旋的前胶原分子,同时进行羟化和糖化。以后被输送到高尔基复合体,继续加工后,由分泌小泡运输到细胞的边缘,经胞吐作用释放到细胞之外,经过肽内切酶,切去两端多余部分,便成胶原分子。由此再经分子间交联聚合而成胶原原纤维,进而粘合成纤维(图2)。此合成过程需经一系列酶的催化,如这些酶的活性下降或缺失,会导致各种胶原分子病。其中有的酶需要维生素C等作辅助因子,维生素C等缺乏会引起胶原纤维结构的不稳固,使血管壁松脆容易出血。
胶原蛋白的分型 胶原蛋白按其分子构成的不同一般分为五型。I型胶原蛋白构成最常见的胶原纤维,由成纤维细胞、成骨细胞、成牙本质细胞产生,主要分布于骨、肌腱、皮肤、器官的被膜及牙本质等处。II型主要由成软骨细胞及软骨细胞产生,构成透明软骨的胶原纤维。III型主要构成网状纤维,由网状细胞和成纤维细胞产生,可同时伴随I型分布。此外,也由血管、肠、子宫的肌层平滑肌细胞合成。IV型和V型是组成基膜基板的重要结构成分,由各种上皮细胞、血管内皮细胞、平滑肌细胞、骨胳肌细胞、Schwann细胞等产生。
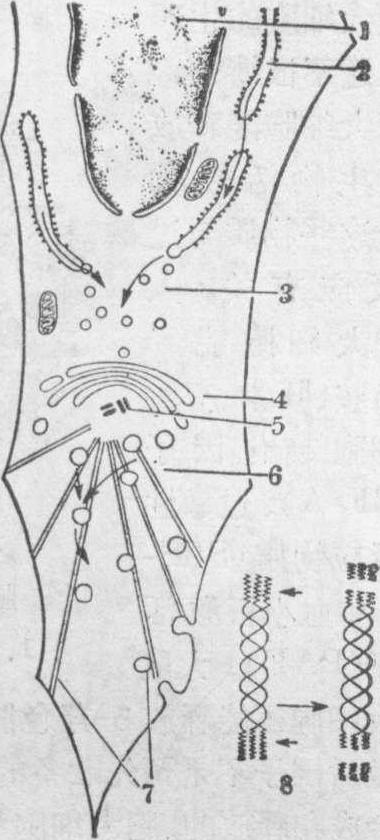
图2 胶原蛋白生物合成模式图
1.细胞核 2.粗面内质网正在合成前胶原蛋白 3.运输小泡4.高尔基复合体 5.中心粒6,7.微管和分泌小泡,前胶原蛋白经此送至细胞外面 8.前胶原蛋白分子在细胞外经酶切短(短箭头示被切处)成胶原蛋白分子
细胞内箭头示前胶原蛋白分子成与运输途径
结缔组织当生长、改建、退化及炎症和修复时,既有新的胶原蛋白和胶原纤维在形成,又有些胶原蛋白分子及胶原纤维被胶原蛋白酶降解。产生胶原蛋白酶的细胞也有多种,如成纤维细胞、滑膜细胞、多形核白细胞、巨噬细胞及皮肤和角膜的上皮等。胶原蛋白分子被胶原蛋白酶消化成分子片段,成为溶液而扩散; 也有的分子片段及部分消化的原纤维被巨噬细胞吞噬,在次级溶酶体内被蛋白酶降解。当生长或损伤及修复后,结缔组织胶原纤维的形成与再吸收之间保持适当的动态平衡。
胶原纤维
collagen fibre
- 比欢是什么意思
- 比正色浓或暗的颜色是什么意思
- 比此是什么意思
- 比武是什么意思
- 比武场是什么意思
- 比武打擂台是什么意思
- 比死人多一口气是什么意思
- 比死人多出一口气是什么意思
- 比比是什么意思
- 比比切切是什么意思
- 比比划划是什么意思
- 比比喻喻是什么意思
- 比比子是什么意思
- 比比样是什么意思
- 比比画画是什么意思
- 比比皆是是什么意思
- 比比皆是;俯拾即是是什么意思
- 比比皆然是什么意思
- 比比看看,美丑自见是什么意思
- 比比触塗是什么意思
- 比比马爬是什么意思
- 比比鬼是什么意思
- 比毛儿灰是什么意思
- 比气道传导率是什么意思
- 比沙是什么意思
- 比沙林人是什么意思
- 比没有稍微好一点儿是什么意思
- 比油耗是什么意思
- 比泥鳅还滑是什么意思
- 比洛是什么意思
- 比洛阳年少,江州司马,多少定谁如。是什么意思
- 比活性是什么意思
- 比浊分析是什么意思
- 比浊法是什么意思
- 比浊法及浊度法是什么意思
- 比浊计是什么意思
- 比湿是什么意思
- 比滑远是什么意思
- 比热是什么意思
- 比热容是什么意思
- 比然是什么意思
- 比照是什么意思
- 比照市场价格标准是什么意思
- 比照市场标准是什么意思
- 比照某事物的道理推出是什么意思
- 比照计算是什么意思
- 比照验证是什么意思
- 比照,比较是什么意思
- 比牙齿是什么意思
- 比物是什么意思
- 比物丑类是什么意思
- 比物假事是什么意思
- 比物属事是什么意思
- 比物属词是什么意思
- 比物属辞是什么意思
- 比物引类是什么意思
- 比物此志是什么意思
- 比物此致是什么意思
- 比物连类是什么意思
- 比物错辞是什么意思