肽链合成的起始
肽链合成的起始
蛋白质合成的起始是将核糖体的两个亚单位与mRNA及起始甲硫氨酰tRNA结合形成起始复合体的多步骤反应。这包括识别mRNA上的特别区域,即“读出”RNA上的起始信号,保证起始甲硫氨酰tRNA的反密码子与mRNA上起始密码子AUG(或GUG) 正确配对,这是mRNA得以忠实地翻译出的关键步骤。肽链合成的起始也是蛋白质合成的限速反应,是调节蛋白质合成的地点。原核细胞的蛋白质合成虽与真核细胞者不尽相同,但对前者的了解多些。
原核细胞蛋白质合成的起始 在原核细胞里,起始的结果是形成70s的起始复合体,参加起始作用的包括有核糖体、mRNA和起始tRNA,还有三个蛋白质因子和GTP。反应可大致分为三步:
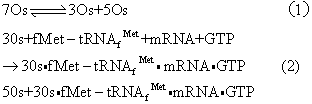
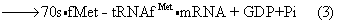
在通常生理条件下,第一步反应的平衡趋于形成70s核糖体,但是起始因子1(IF1)和起始因子3(IF3)促使平衡移向解离成为两个亚单位。IF1增加70s的解缔速度常数,IF3通过与30s亚单位的结合促使平衡趋向解缔。这反应易受正离子影响,Mg2+浓度的增高使第一步反应趋向缔合,而单价正离子的作用正相反。第二步反应要求另一个蛋白质因子,起始因子2(IF2),它涉及fMet-tRNAfMet与核糖体的结合。mRNA与核糖体结合要有IF3。第三步反应伴同这三个因子的释放和GTP的水解。IF3在50s连结前放出,IF1在连结过程中放出,而IF2则在连结后放出。IF2的释放要求GTP。
1965年,Severo Ochoa实验室发现未被含高浓度NH4Cl的缓冲液洗过的核糖体,其翻译人工合成多聚核苷酸和天然mRNA的能力是同等的,但由被含0.5mol/L氯化铵缓冲液洗过的核糖体组成的无细胞体系则只能翻译人工合成多聚核苷酸,而不能翻译如噬菌体MS2、R17和QβRNA这类天然的RNA。不过,当把从核糖体洗液得到的硫酸铵分段物加回该体系,它又恢复翻译天然mRNA的能力。从这有活性的硫酸铵分段物分离出两种蛋白质因子,即IF1和IF2。随后又发现当核糖体用含1mol/L氯化铵的缓冲液洗过,就还要有另一蛋白质因子,即IF3的加入才可恢复无细胞体系翻译天然 mRNA的活性。在细胞粗提取物中,起始因子存在于30s亚单位内,在离心时与核糖体一同沉淀。它们只是在蛋白质合成的一定阶段中临时缔合在核糖体上,但随后就被释放,所以不同于核糖体本身的结构蛋白质。这三种因子均已纯化至均一,它们的抗原性也互不相同,也不同于任一种核糖体蛋白质。
IF1分子量9000,是碱性蛋白质,对热稳定。IF2分子量最大,主要有IF2α(118,000)和IF2β(9800)两型。它们的抗原性相同,可能是同一基因的产物,而β型是α型的降解物,但是都同具活性。IF2是酸性蛋白质,对热不稳定,对巯基试剂敏感。IF3也有两型,一是链长181个氨基酸残基,分子量21000,另一是前者N末端切去6个氨基酸残基,都是碱性蛋白质,都有相同活性。
在无f Met-tRNAfMet和mRNA的条件下,IF1、IF2和IF3协同结合到30s核糖体亚单位上,GTP稳定这种结合。IF3被认为结合到与50s亚单位相交界的30s亚单位面上,这可说明IF3促使70s核糖体解离为两个亚单位。有报道指出,IF3和16s RNA结合,而形成完整核糖体时16s RNA是要和50s亚单位上的23s RNA作碱基配对的。一分子IF3结合到一个30s亚单位; IF1促进这种结合。事实上,起始因子和30s亚单位的结合是高度密切配合的;IF2与30s亚单位的结合也是要IF1和IF3的协助; 在没有这两种因子时,IF2和30s亚单位的结合很不稳定。IF1自身可和30s亚单位结合,但也为IF2和IF3所稳定。既然它们可同时与30s亚单位结合,显然不结合在同一部位上,但这些部位是接近的。交联实验表明,三个因子交联到一些相同的核糖体蛋白质上,主要有S1、S11、S12、S13和S19。IF2-IF1也交联一起。16s RNA的3′端既和上述一些蛋白质交联,也和三个起始因子交联。
一旦起始因子结合到30s亚单位,mRNA和fMet-tRNAfMet的结合也就可以开始了。究竟何种核酸先结合到30s上,尚有争论,但体外实验表明,在一定条件下它们都可各自不依赖另一种核酸单独结合上30s 亚单位。不过,除非mRNA和fMet-tRNAfMet都存在,否则所产生的复合体不稳定;结合的先后可能视mRNA不同而异。mRNA结合到核糖体亚单位这一反应可能是蛋白质合成的限速反应。已知的原核细胞顺反子几乎都是以AUG起始的,只有个别以GUG开始。在多顺反子核酸,其链内顺反子也以AUG为起始密码子。AUG和GUG不只是起始密码子,也分别编码甲硫氨酸和缬氨酸,因而mRNA还要有其他特征区分起始密码子。借助分析受核糖体起始复合体保护免于核酸酶水解的mRNA片段顺序,以及对16s RNA 3′端顺序的比较,有人提出起始密码子5′端有一段富含嘌呤区域与16s RNA 3′ 末端富含嘧啶区域相互作用是识别mRNA起始区的机理。现已知几十种大肠杆菌或噬菌体RNA的起始区含共同的富嘌呤GGAG顺序,可与16s RNA的CUCC顺序配对。IF3直接参与mRNA和30s亚单位的结合。
甲酰甲硫氨酰-tRNAfMet结合到30s 亚单位需要有IF2和GTP,从而形成中间物fMet-tRNA·IF2·GTP。IF2对此起重要作用。这反应对fMet-tRNAfMet要求严格,其他天然氨基酰-tRNA均不能取代之,大多N-封闭的氨基酰tRNA也无活性。每分子fMet-tRNAfMet要求1分子IF2。GTP和IF1也是fMet-tRNAfMet结合到30s亚单位时所必需,但IF3却在此时从30s亚单位上脱下。fMet-tRNAfMet不像其他氨基酰tRNA那样进到核糖体上的A位。这点可从已结合的fMet-tRNAfMet能与嘌呤霉素起反应这点上得到证明。50s亚单位结合到30s起始复合体就形成70s起始复合体。这步反应释放出IF1,然后GTP水解为GDP和Pi,并且也脱落下IF2。把起始因子考虑在内,上述反应可归纳如下:
真核细胞蛋白质合成的起始 蛋白质合成的起始,真核细胞和原核细胞尽管有很多类似之处,但也有明显不同。原核细胞核糖体较小、较简单,真核细胞的核糖体则大得多,也较复杂。原核细胞的起始因子只有三种,而真核细胞者有十种(分别命名为eIF1、eIF2……等,见表);真核细胞起始氨基酰tRNA没有甲酰化;真核细胞核糖体和mRNA的结合需要ATP;起始密码子只有AUG一种;mRNA结构复杂,5′ 端戴“帽”,3′端多聚腺苷酸化,但又总是单顺反子,它与核糖体的结合在Met-tRNAMeti之后。真核细胞还有一个蛋白激酶体系,可起调节起始步骤的作用。
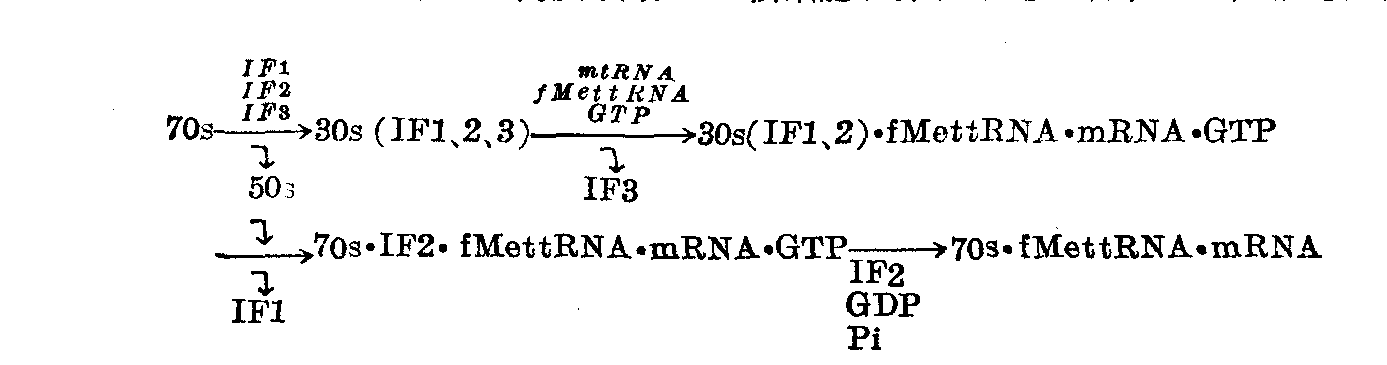
现将研究较详的兔网织红细胞的各种因子列于下表。必须指出,eIF2和eIF3尽管和IF2和IF3起相当的功用,但它们是不同的。eIF2和eIF3都是多亚基蛋白质,前者含三个多肽,分子量分别是55000、52000和38000,后者含9个亚基。eIF1也不同于IF1。
表 真核细胞起始因子(兔网织红细胞)
| 因子 | 分子量 | 肽链数目 | 主要作用 |
| eIF1 eIF2 | 15,000 150,000 | 1 3 | 促进mRNA结合作用 与Met-tRNAfMet和 GTP形成三元复合体 |
| eIF3 | 约700,000 | 约9 | 促进Met-tRNAfMet和 mRNA的结合;核糖 体解缔作用 |
| eIF4A eIF4B eIF4C | 49,000 80,000 17,500 | 1 1 1 | 促进mRNA结合作用 促进mRNA结合作用 促进Met-tRNAfMet 结合作用 |
| eIF4D | 16,000 | 1 | 激动甲硫氨酸-嘌呤霉 素形成 |
| eIF5 | 150,000 | 1 | 80s复合体形成所必需; GTP酶 |
| 辅-eIF2 帽结合因子 | 22,000 24,000 | 1 1 | 激动三元复合体形成 与mRNA的帽结合 |
关于形成80s起始复合体的步骤可简略归纳如下:
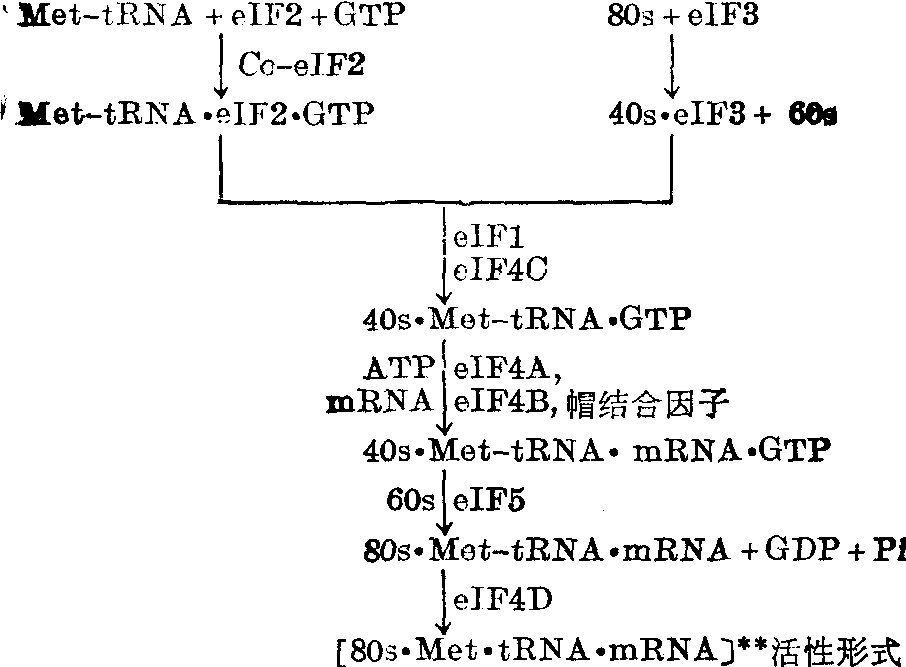
对真核细胞蛋白质合成的调节也有了一些了解。由于网织红细胞胞溶产物的蛋白质合成效率高、产品单一以及对外加高铁血红素的依赖性等特点,网织红细胞胞溶产物是最常用的一种体系。将网织红细胞胞溶产物在无外加高铁血红素下37℃温育,14C亮氨酸的参入作用初速正常,但是温育5分钟后,参入速度急速下降,只及初速的2~10%。经证明,这种抑制作用是阻断新肽链的起始而不影响已经起始了的肽链的延长。加入 eIF2就可恢复起始作用。这种抑制作用亦可在温育早期加入高铁血红素而被除去,但若高铁血红素的加入迟缓了就不能解除抑制。这抑制因子称为高铁血红素调节抑制物 (HCI)。高度纯化了的HCI在聚丙烯酰胺电泳上呈一条区带,分子量约95,000。它具有不依赖cAMP的蛋白激酶活性,可使eIF2的小亚基(38,000)磷酸化,故HCI又称eIF2激酶。经过磷酸化的eIF2 就失去起始蛋白质合成的作用。辅eIF2可促进eIF2与Met-tRNAiMet及GTP形成三元复合体,可能还促进这三元复合体与40s亚单位结合; 而它只能促进未磷酸化的eIF2。当eIF2的浓度愈低,辅eIF2的促进作用愈明显; 当eIF2的浓度已经很高,则可不要辅eIF2来促进。另一方面,HCI是由不具活性的抑制物前体转变而来的,这种转变需要一种依赖cAMP的激酶,而高铁血红素起作用的原因是它结合到这种依赖cAMP的激酶的调节亚基上,使之失去活性。HCI虽是得自网织红细胞,不过高铁血红素也促进或维持非红细胞体系的蛋白质合成,经证实了的细胞包括有Krebs Ⅱ腹水癌细胞、Hela细胞、血小板和肝癌细胞,并且也已经从艾氏腹水癌、Friend白血病细胞和大鼠肝细胞分离出HCI样抑制物。另外,小量双链RNA和氧化型谷胱甘肽也都抑制蛋白质合成,其作用方式类似HCI,即蛋白质合成初速正常,几分钟后急速下降,携带Met-tRNAifMet的40s亚单位减少,多聚核糖体解聚。高浓度eIF2或高浓度cAMP和2氨基嘌呤可解除抑制作用。看来,真核细胞似有一种以磷酸化-脱磷酸化来调节蛋白质合成的机理。
☚ 氨基酸的活化 延伸作用 ☛
- 甲帖是什么意思
- 甲帳是什么意思
- 甲床肥厚症是什么意思
- 甲库是什么意思
- 甲底是什么意思
- 甲庚是什么意思
- 甲庚堂是什么意思
- 甲府是什么意思
- 甲开鱼照水,旗飏虎拏风。是什么意思
- 甲异常病是什么意思
- 甲弩是什么意思
- 甲弯曲是什么意思
- 甲役是什么意思
- 甲恐则坐是什么意思
- 甲感是什么意思
- 甲戌年窦跛蹄雇工契是什么意思
- 甲戌正月十四日书所见,来日惊蛰节·[宋]张元幹原文是什么意思
- 甲戌风灾是什么意思
- 甲戟是什么意思
- 甲手是什么意思
- 甲才是什么意思
- 甲扎是什么意思
- 甲(打《四书》一句)使子路反见之是什么意思
- 甲折翁是什么意思
- 甲拉蛮是什么意思
- 甲拌磷是什么意思
- 甲拍是什么意思
- 甲敌乳油是什么意思
- 甲敌粉是什么意思
- 甲文是什么意思
- 甲 文学是什么意思
- 甲斐是什么意思
- 甲斗乙是什么意思
- 甲方是什么意思
- 甲方单独审查预算是什么意思
- 甲旅札是什么意思
- 甲族是什么意思
- 甲易胡脚是什么意思
- 甲晕是什么意思
- 甲朗聚龙佛寺是什么意思
- 甲本是什么意思
- 甲札是什么意思
- 甲杓肌是什么意思
- 甲来是什么意思
- 甲松是什么意思
- 甲板是什么意思
- 甲板冲洗软管是什么意思
- 甲板刷是什么意思
- 甲板室是什么意思
- 甲板拖把是什么意思
- 甲板提单是什么意思
- 甲板支柱是什么意思
- 甲板板是什么意思
- 甲板横梁是什么意思
- 甲板装运是什么意思
- 甲板设备是什么意思
- 甲板货是什么意思
- 甲板货物是什么意思
- 甲板货物条款是什么意思
- 甲板货物险是什么意思