电离度
电离度dianlidu
当弱电解质在溶液中达到电离平衡时,已电离的电解质分子数占原来总分子数的百分数,称做该电解质的电离度,并用a表示。即

影响电离度的因素:
❶电解质的结构 具有离子键或强极性的分子在水溶液中的电离度均很大,几乎是100%。弱极性或非极性分子在水中呈微弱电离甚至不电离。电解质中键的极性越大,其电离度也越大。离子化合物的电离度取决于离子电荷及离子半径。离子电荷越高,半径越小,则其电离度越小。
❷ 溶剂的性质 溶剂的极性越大,其介电常数越大,则电解质的电离度也越大。如NaCl,因溶剂不同,电离度截然不同。在水中NaCl是强电解质,在苯中NaCl却是弱电解质。
❸ 溶液的浓度 强电解质的电离度受浓度的影响较小,弱电解质的电离度受浓度的影响却很大。溶液越稀,阴、阳离子相互接触形成分子的机会越少,则电离度就越大。
❹温度 电解质电离时,一般需要吸热。升高温度,电离平衡向着电离方向移动,从而电离度增大。
❺ 溶液中存在其他电解质 如果溶液中含有共同离子的其他强电解质,由于同离子效应,则弱电解质的电离度将大大降低; 若含有非共同离子的其他强电解质,因稀释及离子强度的增强,致使弱电解质的电离度加大。
一般说来,在相同的条件下,电解质越强,电离度越大。因此,弱电解质的相对强弱,可用电离度来表示。
强电解质在水溶液中是完全电离的,原则上不存在电离度。但由于离子间存在静电引力的作用,导致它们在宏观上表现出不完全电离,而存在一定的电离度,把强电解质的电离度称做表观电离度。因此,强电解质的电离度也小于1 (见下表)。
一些酸*、碱、盐的电离度 18℃,(0.1 mol·L-1)
| HCl | 0.92 | NaOH | 0.91 |
| HNO3 | 0.98 | 1/2Ba(OH)2 | 0.77 |
| HI | 0.91 | NH3·H2O | 0.013 |
| 1/2H2SO4 | 0.61 | NaCl | 0.84 |
| -H3PO4 | 0.27 | NaNO3 | 0.83 |
| CH3COOH | 0.013 | CH3COONa | 0.79 |
| 1/2H2CO3 | 0.001 7 | 1/2Na2SO4 | 0.70 |
| 1/2H2S | 0.000 7 | 1/2BaCl2 | 0.77 |
| 1/3H3BO3 | 0.000 1 | 1/2ZnSO4 | 0.40 |
| HNC | 0.000 1 |
*表中的多元酸系指一级电离的电离度。
电离度的主要求法有:
❶ 电导法 弱电解质溶液的导电性依懒于溶液中所含的离子数。因此只要测出溶液的电导率,即可求得该电解质的电离度。设任一浓度时的摩尔电导率为Λ,则Λ/Λ°就是与无限稀释时的离子数之比,它等于该浓度下的电离度α,即
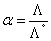
式中Λ为实测值; Λ°由离子独立运动定律求得。
❷溶液的依数性 设溶液中溶有α个分子的n元电解质 (指1个分子电离成n个离子的物质) ,其为α。该溶液中未电离的分子数为a-aα,离子数为naa。假如未电离的分子和离子对依数性有等同的贡献,则溶液中就有a-aa+naa=a〔1+(n-1)α〕 个粒子对依数性作贡献。由于电离使粒子数增加了 〔1+(n-1)α〕倍,所以范特荷夫系数i可表示为i=1+(n-1)α。设对某一电解质实测的凝固点降低值为△Tf,完全未电离时凝固点降低值为△Tf°。于是得
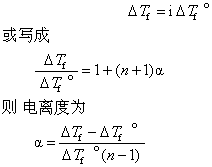
同样,可用沸点升高或渗透压的测定求电离度。
☚ 弱电解质的电离平衡 水的离子积 ☛
电离度
degree of electrolytic dissociation
- 甲硝唑氯己定软膏是什么意思
- 甲硫氧嘧啶是什么意思
- 甲硫酸新斯的明是什么意思
- 甲硫醇是什么意思
- 甲硫醇是什么意思
- 甲磺二冰脲是什么意思
- 甲磺英丙舒凡是什么意思
- 甲磺酸加贝酯是什么意思
- 甲磺酸加贝酯是什么意思
- 甲磺酸卡莫司他是什么意思
- 甲磺酸去铁胺是什么意思
- 甲磺酸去铁胺是什么意思
- 甲磺酸去铁铵是什么意思
- 甲磺酸双氢麦角汀是什么意思
- 甲磺酸地拉韦啶是什么意思
- 甲磺酸培氟沙星是什么意思
- 甲磺酸培氟沙星注射液是什么意思
- 甲磺酸帕珠沙星是什么意思
- 甲磺酸曲伐沙星是什么意思
- 甲磺酸米帕林是什么意思
- 甲磺酸萘莫司他是什么意思
- 甲磺酸酚妥拉明是什么意思
- 甲磺酸酚妥拉明是什么意思
- 甲磺酸非诺多泮是什么意思
- 甲磺隆是什么意思
- 甲磺隆是什么意思
- 甲紫是什么意思
- 甲紫是什么意思
- 甲紫是什么意思
- 甲羟孕酮是什么意思
- 甲羟孕酮是什么意思
- 甲羟孕酮是什么意思
- 甲羟孕酮是什么意思
- 甲羟鎓是什么意思
- 甲羧除草醚是什么意思
- 甲胂酸铁是什么意思
- 甲胺是什么意思
- 甲胺磷是什么意思
- 甲胺磷是什么意思
- 甲胺磷是什么意思
- 甲芬那酸是什么意思
- 甲芬那酸是什么意思
- 甲苯是什么意思
- 甲苯是什么意思
- 甲苯是什么意思
- 甲苯是什么意思
- 甲苯是什么意思
- 甲苯乙酮是什么意思
- 甲苯二异氰酸酯是什么意思
- 甲苯咪唑是什么意思
- 甲苯咪唑是什么意思
- 甲苯咪唑片是什么意思
- 甲苯哒唑是什么意思
- 甲苯比妥是什么意思
- 甲苯磺丁脲是什么意思
- 甲苯磺丁脲是什么意思
- 甲苯磺丁脲是什么意思
- 甲苯磺丁脲是什么意思
- 甲苯达唑是什么意思
- 甲苯酚是什么意思