理想气体状态方程
理想气体状态方程lixiang qiti zhuangtai fang-cheng
习惯上称气态方程。理想气体是人们假想的,这种气体在分子间没有相互作用力,分子本身不占体积。一定质量的理想气体在始态时的压力、体积、热力学温度分别是p1,V1,T1,经过某一变化过程到终态时分别变成p2,V2,T2,气体从始态到终态、可以经过不同变化途径,设想经过一个等温过程,再经过一个等压过程。在第一个变化过程中,温度T1保持不变,压力从p1变成p2,体积从V1变成Va,根据玻意耳定律: 恒温时,一定质量的气体,体积与它承受的压力成反比p1V1=p2Va 或

在第二个变化过程中,当压力P2保持不变时,温度从T1变成T2,体积从Va变成V2,根据盖·吕萨克定律: 恒压下,一定质量的气体,它的体积与热力学
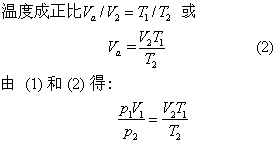
或
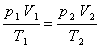
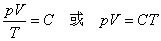
1mol任何理想气体在标准状态下(p0=1.013×105Pa,T0=273K,V0=22.4L)的气体常数R=p0V0/T0,将nmol理想气体(标准状况)占有的体积v0=nV0代入上述气体状态方程可得
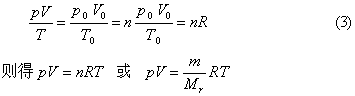
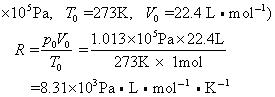
摩尔气体常数的单位和数值
| p | V | T | n | R |
| 帕(Pa) | 升(L) | 开(K) | 摩尔(mol) | 8.31×103 Pa·L·mol-1·K-1 |
| 帕(Pa) | 米3(m3) | 开(K) | 摩尔(mol) | 8.31 Pa·m3mol-1·K-1=8.31J·mol-1·K-1 |
| 大气压* | 升 (L) | 开(K) | 摩尔(mol) | 0.082 atm·L·mol-1·K-1 |
| 大气压* | 毫升 (mL) | 开(K) | 摩尔(mol) | 82 atm·mL·mol-1·K-1 |
| 毫米汞柱* | 毫升 (mL) | 开(K) | 摩尔(mol) | 62359 mmHg·ml·mol-1·K-1 |
| 达因·厘米-2* dyn·cm-2 | 厘米3(cm3) | 开(K) | 摩尔(mol) | 8.31×107 erg·mol-1·K-1 |
* 现已禁用
☚ 气体的状态参量 气态方程式的计算 ☛
- 改变航程条款是什么意思
- 改变落后穷困的面貌是什么意思
- 改变行为是什么意思
- 改变行为准则是什么意思
- 改变行走的路线是什么意思
- 改变行踪,隐姓埋名是什么意思
- 改变行进方向是什么意思
- 改变表情是什么意思
- 改变装扮是什么意思
- 改变装束是什么意思
- 改变装饰或包装是什么意思
- 改变角度是什么意思
- 改变计划是什么意思
- 改变计划或做法是什么意思
- 改变计图是什么意思
- 改变计策是什么意思
- 改变谋略是什么意思
- 改变贫穷落后面貌是什么意思
- 改变身份是什么意思
- 改变过去的话是什么意思
- 改变重装是什么意思
- 改变门第出身,提高家庭的社会地位是什么意思
- 改变预提税税率的证书是什么意思
- 改变风气是什么意思
- 改变,更动是什么意思
- 改变;变化是什么意思
- 改口是什么意思
- 改口沓舌是什么意思
- 改口钱是什么意思
- 改句是什么意思
- 改名是什么意思
- 改名寓志是什么意思
- 改名换姓是什么意思
- 改名易姓是什么意思
- 改名易姓,削发披缁是什么意思
- 改名易姓;削发披缁是什么意思
- 改向是什么意思
- 改向性是什么意思
- 改向行为是什么意思
- 改吟斋是什么意思
- 改咏诗是什么意思
- 改哩是什么意思
- 改唐诗戏惧内某公是什么意思
- 改唡是什么意思
- 改善是什么意思
- 改善住房条件是什么意思
- 改善农业结构提高农民所得方案是什么意思
- 改善因子是什么意思
- 改善国民经济是什么意思
- 改善土路面是什么意思
- 改善工程是什么意思
- 改善战地武装部队伤者、病者境遇的日内瓦公约是什么意思
- 改善战地武装部队伤者境遇的公约是什么意思
- 改善战地武装部队伤者病者境遇的日内瓦公约是什么意思
- 改善投资环境是什么意思
- 改善民生是什么意思
- 改善油性皮肤方法是什么意思
- 改善海上武装部队伤者、病者及遇船难者的日内瓦公约是什么意思
- 改善海上武装部队伤者病者及遇船难者境遇的日内瓦公约是什么意思
- 改善环境卫生是什么意思