化学平衡定律
化学平衡定律huaxue pingheng dinglu
设任一化学反应
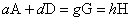
在等温等压下达到平衡时必定有∑υiμi=0,即(gμG+hμH)-(aμA+bμB)=0。又任一物质i的化学势为μi=μi(T,p)+RTlnai,代入上式得到
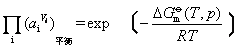
在等温等压下
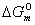 为常数,故
为常数,故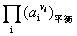 亦是常数。令此常数为Ka,则
亦是常数。令此常数为Ka,则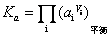
Ka叫化学平衡常数,简称平衡常数。它表示在一定条件下,一个化学反应达到平衡时,产物活度的计量系数次方的乘积与反应物活度的计量系数次方的乘积之比为一常数。这一平衡关系式称化学平衡定律,又叫质量作用定律。此式具有普遍意义,它对气相反应、溶液反应及各种多相反应均可适用。
平衡常数仅是温度、压力的函数,与体系的组成无关。虽然参与反应的各有关物质平衡时的组成因反应勿始时组成的不同而有不同的值,但在平衡时上述的连乘积在一定温度和压力下是个定值。平衡常数是每个化学反应所具有的特征常数,它是在给定条件下化学反应所能达到的最大限度的标志。平衡常数越大,表示反应躁成的程度越高,反应生成产物的相对数量越多; 反之,平衡常数减小,产物的相对数量减少,反应进行得越不完全。
☚ 化学平衡的普遍性 平衡常数的单位 ☛
- 蕴藏是什么意思
- 蕴藏于其中而未全部显现是什么意思
- 蕴藏勇力是什么意思
- 蕴藏在内心的辛酸是什么意思
- 蕴藏在内的美德是什么意思
- 蕴藏在胸中的聪明才智是什么意思
- 蕴藏已久的志愿是什么意思
- 蕴藏有玉的石是什么意思
- 蕴藏未发挥的力量是什么意思
- 蕴藏的思想、感情等是什么意思
- 蕴藏的感情是什么意思
- 蕴藻是什么意思
- 蕴藻浜港区是什么意思
- 蕴藻浜航道是什么意思
- 蕴藻浜船闸是什么意思
- 蕴诗是什么意思
- 蕴辉是什么意思
- 蕴辉珠处渊, 含英金在矿。是什么意思
- 蕴酿是什么意思
- 蕴量是什么意思
- 蕴隆是什么意思
- 蕴香是什么意思
- 蕴香丸是什么意思
- 蕴香丸十卷是什么意思
- 蕴高是什么意思
- 蕶是什么意思
- 蕷是什么意思
- 蕸是什么意思
- 蕹是什么意思
- 蕹
.jpg) 是什么意思
是什么意思 - 蕹菜是什么意思
- 蕹菜枝是什么意思
- 蕹菜汤是什么意思
- 蕹菜(空心菜)是什么意思
- 蕹萃是什么意思
- 蕺是什么意思
- 蕺叶是什么意思
- 蕺园是什么意思
- 蕺子是什么意思
- 蕺山是什么意思
- 蕺山先生是什么意思
- 蕺山文粹是什么意思
- 蕺山脚下 遇妪书扇是什么意思
- 蕺菜是什么意思
- 蕺隐斋是什么意思
- 蕻是什么意思
- 蕻子是什么意思
- 蕻菜是什么意思
- 蕻蕻是什么意思
- 蕼是什么意思
- 蕽是什么意思
- 蕾是什么意思
- 蕾奥诺尔走向泉边是什么意思
- 蕾期授粉法是什么意思
- 蕾肥是什么意思
- 蕾莉与马杰农是什么意思
- 蕾莉与马杰农(节选) [波斯]内扎米是什么意思
- 蕾铃脱落是什么意思
- 蕾(打现代诗人名一)苗得雨是什么意思
- 蕿是什么意思