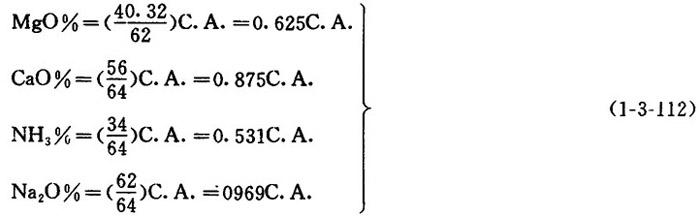
【说明】对酸液中的盐基,常以它们各自的氧化物或易见形式来表示。它们的含量均可通过各自化合酸(C.A.)的含量算得。
【公式】
【例】已知某药槽亚硫酸盐药液中,每升药液内含有化合SO2为32克,游离SO2为1克,求:
❶ 此药液中各种酸的含量;
❷ 求各种盐基组分的含量;
❸ 判断药液的组成。
解:
❶ 化合酸含量C.A.=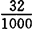 ×100=3.2(g/100mL)=3.2%
×100=3.2(g/100mL)=3.2%
游离酸含量F.A.=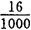 ×100=1.6(g/100mL)=1.6%
×100=1.6(g/100mL)=1.6%
总酸T.A.=C.A.+F.A.
=3.2+1.6=4.8(g/100mL)
=4.8%
❷ 若为铵基药液,则其盐基浓度为:
NH3%=0.531C.A.=0.531×3.2%=1.70%
若为钠盐基药液,则其盐基浓度为:
Na2O%=0.969×3.2=3.10%
同理,若为镁盐时,其盐基浓度为:MgO%=0.625×3.2=2.00%
❸ 因为C.A./F.A.=3.2/1.6>1,所以,镁盐基药液有酸式盐和正盐存在,而有可能因有沉淀而显混浊。此外,也正因如此,钙盐基不能具有这种组成的药液,否则,药液将会含有大量正盐沉淀。
- 香瓜丸是什么意思
- 香瓜子是什么意思
- 香瓜掉进蜜罐里是什么意思
- 香瓜种植农场是什么意思
- 香瓜藤是什么意思
- 香瓜(甜瓜)是什么意思
- 香瓣是什么意思
- 香瓣疮方是什么意思
- 香瓦楼主是什么意思
- 香甑炊菰白,醇醪点蟹黄。是什么意思
- 香甘散是什么意思
- 香甜是什么意思
- 香甜可口是什么意思
- 香甜的睡一觉是什么意思
- 香甜的美酒是什么意思
- 香生是什么意思
- 香生色活是什么意思
- 香田是什么意思
- 香画眉草是什么意思
- 香界是什么意思
- 香界寺是什么意思
- 香畏风吹散。是什么意思
- 香畴是什么意思
- 香畹是什么意思
- 香畹楼是什么意思
- 香畹楼忆语是什么意思
- 香痕是什么意思
- 香痕已成梦,短操谁弹,月冷瑶琴。是什么意思
- 香白是什么意思
- 香白芷是什么意思
- 香皂是什么意思
- 香皂的选购是什么意思
- 香皮皂是什么意思
- 香皮紙是什么意思
- 香皮纸是什么意思
- 香盆是什么意思
- 香盐是什么意思
- 香盒是什么意思
- 香盖是什么意思
- 香盘是什么意思
- 香盟密誓是什么意思
- 香盤是什么意思
- 香着贺呢是什么意思
- 香石是什么意思
- 香石斋是什么意思
- 香石竹是什么意思
- 香石竹枯萎病是什么意思
- 香石竹病害是什么意思
- 香石竹病毒病是什么意思
- 香石竹黑斑病是什么意思
- 香石诗话是什么意思
- 香砂二陈汤是什么意思
- 香砂六君丸是什么意思
- 香砂六君子丸是什么意思
- 香砂六君子汤是什么意思
- 香砂养胃丸是什么意思
- 香砂养胃汤是什么意思
- 香砂四君子汤是什么意思
- 香砂宽中丸是什么意思
- 香砂宽中汤是什么意思