1.盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的.即如果一个反应可以分几步,则各分步反应的热之和与该反应一步完成的反应热相同.
2.盖斯定律的应用:盖斯定律在生产和科学研究中有很重要的意义有些反应的反应热虽然无法直接测得,但可利用盖斯定律间接求得例如,对于反应C(s)+1/2O2(g)=CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的△H无法直接测得,但可以测得C与O2反应生成CO2以及CO与O2反应生成CO2的反应热:
C(s)+O2(g)=CO2(g);
△H1=—393.5kJ/mol
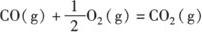
△H2=—283.0kJ/mol
根据盖斯定律,可以很容易求算出C(s)+ 1/2O2(g)=CO(g)的△H.将上述两个方程式相减得:C(s)+1/2O2(g)=CO(g);△H=△H1—△H2.
∴△H=—393.5kJ/mol—(—283.0kJ/mol)=—110.5kJ/mol.
- 五圣还童散是什么意思
- 五地之杀是什么意思
- 五地之胜是什么意思
- 五地之败是什么意思
- 五场沟墓地是什么意思
- 五场沟岩刻是什么意思
- 五场沟岩刻是什么意思
- 五均是什么意思
- 五均是什么意思
- 五均·赊贷·六管法是什么意思
- 五均六筦是什么意思
- 五均六筦是什么意思
- 五均六筦是什么意思
- 五均六筦是什么意思
- 五均六筦(管)是什么意思
- 五均六筦(管)是什么意思
- 五均六筦(管)是什么意思
- 五均汤是什么意思
- 五均论是什么意思
- 五均赊贷是什么意思
- 五均赊贷是什么意思
- 五均赊贷是什么意思
- 五坊小儿是什么意思
- 五坝山汉墓群是什么意思
- 五城是什么意思
- 五城公牍汇存是什么意思
- 五城兵备道是什么意思
- 五城兵马司是什么意思
- 五城兵马司是什么意思
- 五城十二楼是什么意思
- 五堡古墓群是什么意思
- 五堡墓地是什么意思
- 五塔召金刚宝座塔是什么意思
- 五塔寺是什么意思
- 五塔寺是什么意思
- 五塔寺是什么意思
- 五塔寺(北京)是什么意思
- 五塔寺塔(内蒙呼和浩特)是什么意思
- 五壅是什么意思
- 五声是什么意思
- 五声是什么意思
- 五声是什么意思
- 五声反切正韵是什么意思
- 五声听狱讼是什么意思
- 五声性调式及和声手法是什么意思
- 五声调式是什么意思
- 五处是什么意思
- 五处士是什么意思
- 五复丸是什么意思
- 五夜是什么意思
- 五夜峰前曙色浮,曈曈先出海东头。谁将赤手扶羲驭,早向人间照九州。是什么意思
- 五大是什么意思
- 五大是什么意思
- 五大名剧论是什么意思
- 五大员应知应会手册是什么意思
- 五大哨口是什么意思
- 五大哨口是什么意思
- 五大夫是什么意思
- 五大夫是什么意思
- 五大夫(秦皇封松、大夫松)是什么意思