海水热力学特征量之间的相互关系。
它是研究海水平衡热力学的基础。若把质量为m的海水看作平衡的热力学系统,则此系统的热力学关系可通过一些基本的热力学函数(态函数)和热力学参数加以表述。热力学函数,包括内能、熵、焓、自由能和化学势等。系统内部所具有的总能量,称为该系统的内能(U)。
在非绝热过程中,外界对系统作功(W),或者系统从外界吸收热量(Q),都会使系统的内能增加。内能的增量(△U)服从
△U=W+Q
其中,W=-PdV,P为压力,dV为流体体积(V)的改变量。于是上式的微分式
dU=dQ-PdV
此即热力学第一定律,描述了系统能量的转化和守恒关系。在宏观的不可逆过程中,常引用熵(η)的概念,其改变量(dη)与热量改变量(dQ)和温度(T)的关系为
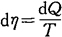
所以 Tdη=dU+PdV
这就是热力学第二定律的微分方程式。
常用的基本热力学参数式有
H=U+PV
F=U-Tη
G=U+PV-Tη
dU=Tdη-PdV+μdS
式中,H、F、G、μ和S分别为焓、亥姆霍兹自由能、吉布斯自由能、化学势和盐度。
- 外夷贸易条规是什么意思
- 外夷通事是什么意思
- 外夹河大桥是什么意思
- 外套是什么意思
- 外套 [俄国]果戈理是什么意思
- 外套腔是什么意思
- 外套膜是什么意思
- 外女是什么意思
- 外奶是什么意思
- 外奶奶是什么意思
- 外奶奶家是什么意思
- 外好里丫杈是什么意思
- 外好里丫槎是什么意思
- 外好里枒槎是什么意思
- 外妇是什么意思
- 外妈是什么意思
- 外妈厝是什么意思
- 外妈食是什么意思
- 外妗是什么意思
- 外妹是什么意思
- 外妻是什么意思
- 外始式是什么意思
- 外姐是什么意思
- 外姑是什么意思
- 外姑婆是什么意思
- 外姓是什么意思
- 外姓人是什么意思
- 外姓旁人是什么意思
- 外姓选于旧是什么意思
- 外姓阴谋篡权是什么意思
- 外委是什么意思
- 外委千总是什么意思
- 外委把总是什么意思
- 外姨婆是什么意思
- 外姻是什么意思
- 外娘是什么意思
- 外婄是什么意思
- 外婆是什么意思
- 外婆厝是什么意思
- 外婆奶是什么意思
- 外婆奶奶是什么意思
- 外婆娘是什么意思
- 外婆娘娘是什么意思
- 外婆家是什么意思
- 外婆家马塍店是什么意思
- 外婆待外孙(丈母娘疼女婿)——真心实意(诚心诚意)是什么意思
- 外婆得了个小儿子是什么意思
- 外婆打孩子——吓唬吓唬是什么意思
- 外婆教我做人是什么意思
- 外婆死了儿是什么意思
- 外婆死崽有得舅是什么意思
- 外婆爹是什么意思
- 外婆的情书是什么意思
- 外婆门是什么意思
- 外婚是什么意思
- 外婚制是什么意思
- 外嫁是什么意思
- 外嫲是什么意思
- 外嬖是什么意思
- 外嬝是什么意思