1.水的电离方程式:水是一种极弱的电解质,
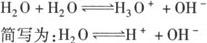
2.水的离子积:
在一定温度时,水电离产生的c(H+)与c(OH—)的乘积是一个常数,表示为:Kω=c(H+)·c(OH—).
在25℃时:
c(H+)=c(OH—)=1×10—7mol/L;
∴Kω=c(H+)·(OH—)=1×10—7×1×10—7=1×10—14.
注 ❶ Kω只与温度有关,与溶液的酸、碱性无关.
❷ 温度升高,Kω也随著增大因水的电离过程是吸热过程,升高温度,促进水的电离,使c(H+)、c(OH—)同时增大,所以Kω也随著增大,但c(H+)与c(OH—)仍然相等,故水仍显中性.
❸ Kω不仅适用于纯水,也适用于任何酸、碱、盐的稀溶液,在25℃时,Kω都等于1×10—14.
❹ 水的电离平衡遵循勒沙特列原理.
- 奶豆腐小面包是什么意思
- 奶豆腐排是什么意思
- 奶豆腐煎饼卷是什么意思
- 奶豆腐饺子是什么意思
- 奶豚子是什么意思
- 奶酒是什么意思
- 奶酒酒湩是什么意思
- 奶酒飘香是什么意思
- 奶酪是什么意思
- 奶酪制作业是什么意思
- 奶酪厂工人是什么意思
- 奶酪的由来是什么意思
- 奶酪高温杀菌器是什么意思
- 奶醅是什么意思
- 奶闺女是什么意思
- 奶阿伯是什么意思
- 奶雪(奶昔)是什么意思
- 奶饮是什么意思
- 奶麻是什么意思
- 奶麻子是什么意思
- 奶黄子未褪是什么意思
- 奶鼓是什么意思
- 奶龙是什么意思
- 奶𧲌儿是什么意思
- 奶𫗦子是什么意思
- 奶𬱭肉是什么意思
- 奷是什么意思
- 奸是什么意思
- 奸不厮欺,俏不厮瞒是什么意思
- 奸久是什么意思
- 奸乱是什么意思
- 奸事是什么意思
- 奸人是什么意思
- 奸人、佞人是什么意思
- 奸人之雄是什么意思
- 奸人出入不觉是什么意思
- 奸人恶人, 以不相识为幸, 如在亲知, 惟有敬而远之一法。是什么意思
- 奸人暗害是什么意思
- 奸人的相是什么意思
- 奸人,邪佞的人是什么意思
- 奸伏是什么意思
- 奸伪是什么意思
- 奸伪百出是什么意思
- 奸佞是什么意思
- 奸佞1是什么意思
- 奸佞2是什么意思
- 奸佞之人利用世道不公、天下纷乱之时盗取名誉是什么意思
- 奸佞小人是什么意思
- 奸佞巧诈是什么意思
- 奸佞狡猾的坏人是什么意思
- 奸佞的人是什么意思
- 奸便是什么意思
- 奸俏是什么意思
- 奸倭是什么意思
- 奸倯是什么意思
- 奸党是什么意思
- 奸党,私党是什么意思
- 奸兰是什么意思
- 奸凶是什么意思
- 奸凶正驱驰,不合问君子。是什么意思