1.氨的分子结构:

2.氨的物理性质:
无色、有刺激性气味的气体,密度比空气小,易液化为无色液体,同时放出大量热,液氨汽化时,吸收大量的热,使周围的温度急剧下降.氨气极易溶于水,常温常压下,1体积水能溶解700体积的氨气,氨的水溶液叫氨水.
3.氨的化学性质:
❶ NH3与水反应:
NH3不仅溶于水,且大部分NH3与水结合成NH3·H2O.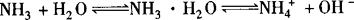
所以氨水是混合物,主要微粒有:H2O、NH3·H2O、NH3、OH—、H+、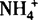 ,呈碱性.
,呈碱性.
注意 ❶ 计算氨水的质量分数和物质的量浓度时,溶质应为NH3,而不是NH3·H2O;
❷ 氨水的密度小于1,且随氨水浓度增大,密度减小.
❷ NH3与酸反应生成铵盐.
如:NH3+HCl=NH4Cl
将NH3通入浓的挥发性酸(如浓盐酸、浓硝酸)中,会产生大量的烟
❸ NH3与某些强氧化剂反应:

4.氨气的实验室制法:
(1)用铵盐与消石灰混合加热制取NH3:
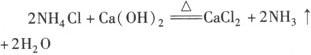
发生装置: (同实验室制O2的发生装置).
(同实验室制O2的发生装置).
(2)向浓氨水中加强碱或生石灰:
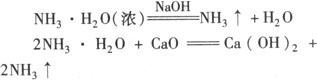
收集:向下排空气法收集.
检验:a.用湿润的红色石蕊试纸检验变蓝.
b.用沾有浓盐酸的玻璃棒接近瓶口产生白烟.
干燥:用碱石灰干燥.不能用浓H2SO4或无水CaCl2干燥.因为NH3与CaCl2反应生成CaCl2·8NH3.
- 伊犁哈萨克自治州人民检察院是什么意思
- 伊犁哈萨克自治州农业学校是什么意思
- 伊犁哈萨克自治州友谊医院是什么意思
- 伊犁哈萨克自治州奎屯供销合作大厦是什么意思
- 伊犁哈萨克自治州旅游局是什么意思
- 伊犁哈萨克自治州歌舞团是什么意思
- 伊犁哈萨克自治州烟草专卖局(公司)是什么意思
- 伊犁哈萨克自治州电视台是什么意思
- 伊犁哈萨克自治州电视录像转播台是什么意思
- 伊犁哈萨克自治州畜牧兽医中等专业技术学校是什么意思
- 伊犁哈萨克自治州科技协会是什么意思
- 伊犁哈萨克自治州红旗幼儿园是什么意思
- 伊犁哈萨克自治州行政区划是什么意思
- 伊犁哈萨克自治州(伊宁市)是什么意思
- 伊犁四方集团是什么意思
- 伊犁地区是什么意思
- 伊犁地区人民广播电台是什么意思
- 伊犁地区体育运动学校是什么意思
- 伊犁地区技工学校是什么意思
- 伊犁地区旅游局是什么意思
- 伊犁地区水资源是什么意思
- 伊犁地区第一中学是什么意思
- 伊犁垦区报是什么意思
- 伊犁大酒店是什么意思
- 伊犁官钱局是什么意思
- 伊犁宝伊局是什么意思
- 伊犁实业公司是什么意思
- 伊犁察哈尔是什么意思
- 伊犁将军是什么意思
- 伊犁将军府旧址是什么意思
- 伊犁将军马广奏议是什么意思
- 伊犁小叶白蜡保护区是什么意思
- 伊犁少年报是什么意思
- 伊犁山地植被垂直带谱是什么意思
- 伊犁州是什么意思
- 伊犁州人民政府托儿所是什么意思
- 伊犁州外贸公司是什么意思
- 伊犁州奶牛场是什么意思
- 伊犁州教师进修学院是什么意思
- 伊犁州教育学院是什么意思
- 伊犁州直儿童福利院是什么意思
- 伊犁州直城镇居民最低生活保障是什么意思
- 伊犁师范学校是什么意思
- 伊犁师范学院是什么意思
- 伊犁师范学院中亚研究所是什么意思
- 伊犁师范学院图书馆是什么意思
- 伊犁庙是什么意思
- 伊犁府是什么意思
- 伊犁弓鱼是什么意思
- 伊犁总统事略是什么意思
- 伊犁拗陷是什么意思
- 伊犁斯克是什么意思
- 伊犁新军是什么意思
- 伊犁新满营是什么意思
- 伊犁新灰蝶是什么意思
- 伊犁新疆时报是什么意思
- 伊犁日报是什么意思
- 伊犁日记是什么意思
- 伊犁木材公司是什么意思
- 伊犁朵帕是什么意思