键能的计算
键能的计算jianneng de jisuan
在1.01×105Pa和25℃下,将1mol理想气体分子AB拆开,成为理想气态1molA原子和1molB原子,所需要的能量叫做AB的离解能(单位为kJ·mol-1),常用符号D(A—B)表示,例如D(H—H)=435.6 kJ·mol-1。对于双原子分子,离解能就是键能E,如E(H—H)=D(H—H)=435.6kJ·mol-1。对多原子分子来讲,键能和离解能是有区别的。例如,NH3分子有3个等价的N—H键,但每个键的离解能是不一样的:
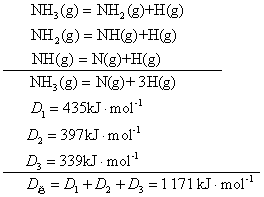
在NH3分子中N—H键的键能就是3个等价键的平均离解能,E(N—H)=1/3D总=1/3×1171=390kJ·mol-1。根据键能作以下几方面的计算:
❶气态单质生成气态化合物时,计算生成热。例1 已知键能数据(kJ·mol-1),D(H—H)435.6,D(N≡N)944.7,D(N—H)390.4,求氨气的生成热。
解 根据盖斯定律得知,化学反应的热效应只与物质的初态、终态有关,无论经过什么途径,其热效应相等。反应分两步进行:
首先,反应物分子H2,N2离解为自由原子,吸收热量为Q1和Q2。
H2(g)→2H(g)-Q1 Q1为D(H—H)
N2(g)→2N(g)-Q2 Q2为D(N≡N)
其次,由上式产生的原子结合成2mol NH3时,放出热量为Q3。
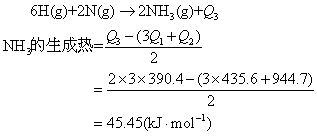
氢气和氮气合成氨的热化学方程式:
N2(g)+3H2(g)=2NH3(g)+90.9kJ
❷根据反应热计算键能。
例 2 已知H—H键能是435.6kJ·mol-1,Cl-Cl键能为242.4kJ·mol-1,H2(g)+Cl2(g)=2HCl(g)+184.8kJ,求HCl的键能。
分析 反应物H2,Cl2拆键吸收热量,生成HCl成键过程要放热。
解 根据H—H键能是435.6kJ·mol-1
Cl—Cl键能为242.4kJ·mol-1,又根据吸热、放热的总效果184.8kJ,设H—Cl键能为x:
2x-(435.6+242.4)=184.8x=431.4(kJ·mol-1)
答 HCl键键能为431.4kJ·mol-1。
☚ 求中和热 电解产物的计算 ☛
- 康乃馨的情怀是什么意思
- 康乃馨鲜花精品屋是什么意思
- 康义诚是什么意思
- 康乌泽克沟是什么意思
- 康乐是什么意思
- 康乐三是什么意思
- 康乐中葡幼稚园是什么意思
- 康乐之休是什么意思
- 康乐公是什么意思
- 康乐县是什么意思
- 康乐县(附城镇)是什么意思
- 康乐园是什么意思
- 康乐园温泉高尔夫俱乐部是什么意思
- 康乐地理学是什么意思
- 康乐宜年是什么意思
- 康乐屐是什么意思
- 康乐毓秀是什么意思
- 康乐活动是什么意思
- 康乐球是什么意思
- 康乐老人是什么意思
- 康乐道是什么意思
- 康乐青铜刀是什么意思
- 康乐饮料公司是什么意思
- 康买得救父杀人案是什么意思
- 康乾盛世是什么意思
- 康了是什么意思
- 康了之中是什么意思
- 康亚香家庭自办幼儿园是什么意思
- 康人是什么意思
- 康什维尔是什么意思
- 康代光是什么意思
- 康以泰是什么意思
- 康仪理氏是什么意思
- 康仲是什么意思
- 康仲伯是什么意思
- 康仲殷是什么意思
- 康伊是什么意思
- 康传圭是什么意思
- 康伯是什么意思
- 康伯可是什么意思
- 康伯筋膜是什么意思
- 康伯藩是什么意思
- 康住是什么意思
- 康住住的人物故事|评价|小传,康住住的事迹|史鉴是什么意思
- 康佐是什么意思
- 康佐苗是什么意思
- 康佑是什么意思
- 康佩珩是什么意思
- 康侯是什么意思
- 康侯三接是什么意思
- 康侯马是什么意思
- 康俊仁是什么意思
- 康保县是什么意思
- 康保县(康保镇)是什么意思
- 康健是什么意思
- 康健民是什么意思
- 康健路是什么意思
- 康僚是什么意思
- 康僚集是什么意思
- 康僧会是什么意思