血细胞的起源、生成和破坏
在机体的造血组织中,血细胞经历了一个较长的细胞增殖、分化、成熟和释放的过程而生成血液的各种有形成分。一个体重50kg的成人,每天约有1.3×1011个红细胞、4.3×1019个粒细胞,1.3×1011个血小板生成,同时也有相同数量的细胞死亡。因此,血细胞的生成及破坏处于一个动态平衡的过程。
血细胞的起源 血细胞发生的传统学说有一元论、二元论及多元论等,这些学说虽各有分歧,但都推测认为各原始血细胞起源于网状细胞。自六十年代应用脾结节等实验技术以来,已有充分证据证明,各种血细胞均起源于多能造血干细胞(pluripotent hematopoietic stem cell,CFU-S)而非网状细胞。
从人类胚胎第3周起造血活动即开始出现,可相继分为中胚叶期(卵黄囊造血)、肝脏期和骨髓期。现已证实,胚胎期各器官的造血功能,都是由胚胎间叶细胞在卵黄囊血岛最先形成CFU-S,CFU-S在卵黄囊血岛发生后,先就地造血,然后经血流迁移至肝脏和脾脏造血,胎儿至第四个月时脾脏中的CFU-S又经血流迁移至骨髓,引起骨髓造血并维持终生。
CFU-S是产生血液有形成分的祖细胞,它既能不断地推进自我更新,在造血组织中维持着干细胞库的恒定数量,同时又具有向骨髓红系、粒系及单核系、巨核细胞系和淋巴系分化的能力,从而维持正常机体的恒定造血(见图)。
1961年,Till和McCulloch发现,将正常小鼠的骨髓细胞输注给受致死剂量射线照射的小鼠,8~10天后,受体小鼠脾脏上可以生成肉眼可见的,由骨髓红系、粒系和巨核系细胞组成的脾结节。以后用标记染色体技术证明,每个脾结节中的全部细胞都起源于单一的细胞。因此,这种脾结节生成细胞被称为脾集落形成细胞(colony fo-rming unit-spleen,CFU-S)即多能造血干细胞。近年来,应用标记染色体、免疫学和细胞动力学等实验方法所进行的动物实验和临床观察证明,淋巴细胞也是由CFU-S所产生的。
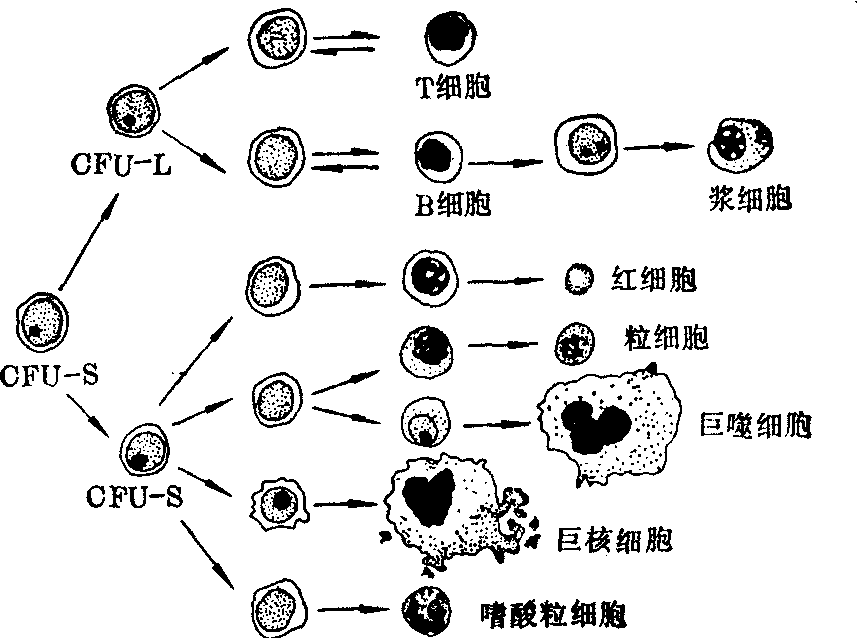
血细胞的起源与生成
CFU-S主要存在于骨髓等造血组织中,也有少量循环于外周血中。CFU-S的数量较少,约占骨髓有核细胞总数的0.5~1.0%。在正常情况下,大部分CFU-S处于休止状态。当机体需要较多血细胞供应时,CFU-S就开始增殖,成为定向干细胞(committed stem cell),再发展成原始红细胞、原始粒细胞、原始单核细胞、原始巨核细胞或原始淋巴细胞。每个进入分化的干细胞离开干细胞库,经过有限的几次分裂开始成为分化的血细胞,并释放入外周血发挥其生理功能。同时,干细胞库在继发的反馈刺激作用下,CFU-S由休止状态进入细胞分裂,维持了干细胞库的稳定。CFU-S的增殖与分化受某些细胞(如T淋巴细胞、干细胞本身)、微环境以及细胞表面药物受体、环化酶系统和神经体液等多种因素的控制和调节。
一般认为CFU-S在形态上很象淋巴细胞。但与通常的小淋巴细胞比较,CFU-S具有体积略大,核仁明显,核染色质疏松,细胞器较少的特点。目前,已有越来越多的证据表明,CFU-S是一个非均一的细胞群体,难以划分出单一的一种细胞形态。对CFU-S细胞群体密度分离的研究发现,CFU-S可划分出几个不同的亚群,不仅它们之间的物理性质不同,而且分化能力以及对药物的敏感性也有差异。还有一种意见认为,小淋巴细胞中有一部分是CFU-S,在某种情况下能被激活转化。
红细胞的生成、破坏及其调节 CFU-S在造血诱导微环境的影响下分化为定向干细胞。造血诱导微环境包括造血干细胞所在环境中的微血管系统(主要为血窦),神经系统和造血间质等部分,通过体液因子对造血干细胞的增殖和分化起着特殊影响。红系定向干细胞在红细胞生成素(erythropoietin,Ep)的刺激下分化为原始红细胞。
随着红系细胞的不断成熟,红系定向干细胞向原始红及早幼红细胞方向不断增殖、分化。根据骨髓细胞分裂指数以及核素测定的人骨髓原始红和早幼红细胞增殖时间各为20小时,中幼红细胞为30小时,晚幼红细胞不具有合成DNA的能力,因此属于非增殖性细胞。
红细胞的生成可分为二类:一类为正常的红细胞生成,由一个红系定向干细胞分化来的原始红细胞连续4次分裂,经历了早幼红、中幼红、晚幼红和网织红等阶段,最后生成16个成熟红细胞(图中只画出一半); 另一类则为“无效造血”,或为加速成熟的过程。
随着红系细胞的不断成熟,每个有核红细胞中血红蛋白的含量不断增加,而DNA的含量却不断减少。在中幼红细胞分裂后的子细胞中,血红蛋白的含量超过了13.5pg时,细胞就失去了继续分裂的能力而成熟为晚幼红细胞,并进入脱核阶段。脱出的裸核大部分被单核-巨噬细胞所吞噬或在脾脏中碎裂溶解。
成熟红细胞的释放是骨髓红细胞造血的最后一个过程。电镜观察证明: 红细胞通过骨髓血窦壁、内皮细胞联合处而进入血液。
正常成人每天约生成1.3×1011个网织红细胞,骨髓网织红细胞的数量为5.0×10
 /kg, 血网织红细胞为3.3×109/kg。血网织红细胞与骨髓网织红细胞的比例约为0.59~0.77。成熟时间约为24~48小时。
/kg, 血网织红细胞为3.3×109/kg。血网织红细胞与骨髓网织红细胞的比例约为0.59~0.77。成熟时间约为24~48小时。采用核素标记测定正常红细胞的生存时间为100~130天,平均为120天,红细胞衰老时,红细胞内己糖激酶、磷酸葡糖异构酶和三磷酸腺苷等逐渐失去活力,使依赖这些酶和三磷酸腺苷的代谢过程产生障碍。此外,磷酸己糖旁路的衰竭也导致血红蛋白结构与功能的改变。衰老的红细胞渗透性增强,变形性能减弱,形态上逐渐由盘状变成球形,最后在脾、肝等脏器被单核-巨噬细胞所吞噬、破坏而消灭。
一个70kg体重的正常男性,骨髓总重量为体重的3.4~5.9%,约3,000g,大致与肝重相当。每日循环的红细胞数约为26×1012,相当于750g血红蛋白。红细胞生存时间为120天,每天约有1/120的红细胞死亡,6.25g血红蛋白分解(释放21mg铁,250mg胆红素)。因此,每日也有相应的红细胞及血红蛋白生成。
在骨髓红细胞生成过程中,除了正常的红细胞生成以外,还存在着另一类无效造血,即幼稚红细胞在增殖和成熟过程中,由于某种原因,在骨髓内“原位”溶血,或进入循环后几小时即死亡,称为红细胞无效性生成。在正常人,红细胞无效性生成约占总造血的10%,但在某些贫血如巨幼细胞贫血、海洋性贫血、铁粒幼细胞贫血等病理状态时,无效红细胞造血明显增加。
缺氧本身并不直接作用于骨髓,而是引起红细胞生成素的释放,进而刺激造血功能。在红细胞的生成调节中,红细胞生成素是起着重要作用的一种体液调节因子。红细胞生成素(Ep)是一种糖蛋白,分子量约60,000~70,000,在血清蛋白电泳中位于α球蛋白的区带上。肾脏是生成Ep的主要器官。此外,肝脏可能也产生Ep。但也有认为肾脏本身并不直接生成Ep,而是在肾脏细胞的线粒体中存在着具有酶特性的肾脏红细胞生成因子(erythrogenin),它释放入血后可使存在于血浆中的Ep前体或不具有Ep活性的红细胞生成素原 (erythropo-ietinogen)转变为Ep。
骨髓组织有神经纤维的分布,并且终止于骨髓细胞的附近。其作用可能是通过神经垂体激素或通过植物神经系统影响血管运动、改变血窦大小及血流速度以及加速Ep的释放。
其他能影响红细胞生成的物质尚有雄激素。雄激素对红系造血所起的作用主要是刺激Ep的产生。它对肾脏红细胞生成素原的刺激作用在缺氧时尤为明显。雄激素可能还具有增加Ep敏感细胞数目的作用。体内注射睾酮或在骨髓细胞的体外培养体系中加入睾酮都有驱使,G0期CFU-S进入DNA合成期的作用,此外也可直接作用于红细胞的生成。
小剂量雌激素可减低红系定向干细胞对Ep的反应,在很大剂量时可能有抑制Ep生成的作用。甲状腺素可促进红细胞造血,可能是增加组织对氧的需求而间接起作用的。肾上腺皮质激素和生长激素可能也是同样的机理继发地作用于红细胞造血。
环腺苷酸(cAMP)在啮齿类动物已证明有刺激红系造血的作用。由于其作用可被Ep抗体所阻断,因此其作用可能在于刺激Ep的生成。此外,通过cAMP引起兔骨髓培养中氨基γ酮戊酸合成酶活性的增加,表示可能对骨髓具有直接的作用,但铁的摄入或血红素的总合成并未见增加。
此外,溶血产物、血红蛋白或血红素注射入体内只能刺激红细胞的生成,这被认为是红细胞破坏释放的终末产物对红细胞造血的反馈调节,可能代表一种毒性的或药理的因子作用于Ep的生成。
粒细胞的生成、破坏及其调节 粒细胞定向干细胞(colony forming units-culture,CFU-C)能分化成原始粒细胞,但其转化的机理尚不清楚。一般认为,一个CFU-C分化为原始粒细胞后,在原始粒和早幼粒阶段各分裂一次,中幼粒细胞分裂二次,最后成熟为16个晚幼粒细胞。在稳定的造血状态下,粒细胞从骨髓生成,释放入血液并进而逸入组织。在骨髓、血液和组织之间存在着动态的平衡。
粒细胞在外周血中的过渡时间很短,正常人标记粒细胞在外周血中减少一半的时间(T1/2)为6~7小时,因而过渡时间约为9~10小时,而骨髓向外周血输出粒细胞的速率163×107/kg·d,相当于骨髓粒细胞的生成速率。
粒细胞主要在毛细血管丰富的脏器(肺、肝、脾、消化道等) 以随机方式离开血管进入组织。粒细胞一旦进入组织就不再返回血液并在其中死亡,或经呼吸道和消化道粘膜表面随分泌液而排出。在组织中粒细胞的生存时间为1~2天。在正常造血的情况下,从造血干细胞到晚幼粒细胞大约要经历140小时,到成熟的粒细胞并出现在外周血中大约要经历284~367小时。
正常人外周血粒细胞的数目维持恒定,粒细胞数目维持恒定的状态受着下列各因素的调节: 干细胞向粒系细胞的输入速率; 幼稚粒细胞在成熟过程中的分裂次数和细胞周期时间;粒细胞从骨髓储备池进入外周血的速率;粒细胞在边缘池和循环池之间的分布; 粒细胞从血液逸出至组织的速率;成熟粒细胞的生存时间。
在上述环节的调节中,除细胞间直接的相互作用外,还通过各种体液因子发挥作用。其中包括刺激物和抑制物可以特异地影响和控制其生长的动力过程。在骨髓粒细胞生成方面,当前研究较多的有:
集落刺激因子 (colony-stimulating factor,CSF):CSF是一种能在体外刺激粒细胞和巨噬细胞增殖的体液因子,其体外作用的靶细胞是粒系定向干细胞。CSF广泛存在于各种动物的血清和尿中,不具有明显的种系和组织特异性。从人尿中分离的CSF是一种糖蛋白,分子量约为45,000。人CSF的最主要来源为外周血白细胞,特别是单核细胞。此外,巨噬细胞、肺泡和腹膜上皮细胞、附着于骨髓腔壁的基质细胞以及肝脏巨噬细胞等也是产生CSF的来源。淋巴细胞在与抗原或有丝分裂原反应时也释放出CSF。细菌内毒素能增加CSF的释放。CSF只对粒细胞和单核-巨噬细胞的生长有刺激作用。动物实验证明,CSF可以缩短细胞周期时间,增加细胞分裂次数并且具有加速骨髓粒细胞成熟和释放的作用。
外周血白细胞增多诱导因子(leukocytosis inducingfactor,LIF): 是调节外周血中性粒细胞数量的一种体液因子,其生化性质还不明了。当它在体液中的浓度或活力增高时,可以加速骨髓中性粒细胞的成熟或释放速率,并使贮藏池的中性粒细胞向循环池粒细胞转移,但并不直接作用于骨髓的粒细胞生成。
抑素(chalone): 是由成熟粒细胞释放的一种低分子量的物质,对增殖的粒系细胞有抑制DNA合成的作用,主要作用于定向干细胞阶段,但对CFU-S的增殖并无明显的直接抑制作用。
乳清脂褐质(lactoferrin):是一种与铁结合的糖蛋白,存在于成熟粒细胞的特殊颗粒中。近年来发现,它是一种粒细胞生成的生理性负反馈调节剂。体外实验证明,它能抑制粒-巨噬细胞克隆的形成。此外,在体内对小鼠的粒细胞造血也有调节抑制作用。
机体对粒细胞生成和释放的控制存在着完善的反馈调节系统。体内一方面不断地产生CSF,同时损伤的细胞也不断地释出CSF,CSF作用于CFU-S可以促进粒细胞和巨噬细胞的生成,后者对损伤组织或细胞起着清理的作用,从而降低CSF水平,这样CSF就可能在应激条件下对粒细胞和巨噬细胞生成的要求以及在正常时保持生成的稳定发挥着调节的作用。此外,通过负反馈的调节作用,成熟粒细胞的增多也具有抑制粒细胞进一步生成的作用。至于外周血粒细胞的数目则又受二个反馈调节环的制约,其中一个作用较缓慢,控制着干细胞向粒系的输入; 另一个作用较快,控制着骨髓粒细胞的释放,从而对外周血粒细胞的数目进行调节。
单核细胞的生成、破坏及其调节 单核细胞的生成与造血组织密切相关。骨髓是生成单核细胞的重要部位。外周血中的单核细胞实际上处于一个细胞系列的中间阶段,其最初阶段的细胞是在正常骨髓中尚不能辨认的原单核细胞,以后经过幼单核细胞及单核细胞阶段,最后成为组织中的巨噬细胞(包括在结缔组织、肝、脾、肺、淋巴结、浆膜腔和骨髓等处游离和固定的巨噬细胞),因此单核细胞也称为单核-巨噬细胞。
对急性粒单核细胞白血病和慢性粒细胞白血病的观察表明,单核巨噬细胞与粒细胞有着共同的祖细胞。此外,对骨髓细胞的体外培养发现,随着培养时间的延长,CFU-C细胞团中单核巨噬细胞的比例逐渐增长,甚至在培养后期细胞团中的绝大部分细胞成为单核巨噬细胞,反映了单核细胞与骨髓粒系细胞之间存在的联系。但是,对于从骨髓CFU-S向粒系或向单核细胞定向分化的水平阶段及其调节因素,目前尚不清楚。
在正常情况下,单核细胞的增殖仅见于幼单核细胞阶段,但当遇到抗原、炎症等刺激时,单核细胞及不成熟的巨噬细胞都可以发生增殖; 在CSF刺激下体外培养的单核细胞,分裂后可直接变为不成熟巨噬细胞而不须经过单核细胞的中间阶段。骨髓储存单核细胞的容量很小,因此单核细胞的成熟过程不仅存在于骨髓,还继续于外周血中。大部分直接从原单核细胞演化来的单核细胞迅速离开骨髓,只有小部分单核细胞留在骨髓内数小时或数天。正常人骨髓幼单核细胞的增殖时间为29小时,DNA合成时间约占10小时。骨髓中幼单核细胞的通过时间约为55小时,相当于二个增殖周期的时间亦即经历二次的分裂。
外周血液中的单核细胞总体(8.1×107/kg)也包含了循环池(1.8×107/kg)和边缘池(6.3×107kg)二个部分,后者约为前者的三倍。单核细胞离开外周血的过程是一个随机过程,一旦离开血液进入组织即不再返回。正常单核细胞生成速率平均为7×106/h·kg。根据对人急性单核细胞白血病患者研究的结果,血液单核细胞在血中的生存时间约为3天,白血病单核细胞则平均为6天。单核细胞进入组织后转化为巨噬细胞。正常时,在组织中巨噬细胞也具有一定的增殖活性,但大多数处于休止状态。巨噬细胞的生存时间尚未确定,可能与细胞发育所在的部位有关。有些细胞在体外可生存几个月。
关于单核细胞生成的调节,在体外培养中,只有在CSF刺激下才有CFU-C细胞团的生长,其中也包括了粒细胞或巨噬细胞。此外,单核巨噬细胞本身也是CSF的重要来源,在粒和单核细胞的生成上发挥着调节的作用。除了CSF以外,皮质激素能阻断单核细胞从骨髓向血液释放,并加速离开外周血,使血液中单核细胞的数目明显下降。
血小板的生成、破坏及其调节 血小板系包括造血组织中的巨核细胞和循环于外周血中的血小板两个部分。巨核细胞由骨髓CFU-S分化生成。它在骨髓中的成熟次序为原巨核细胞—→幼巨核细胞—→颗粒型巨核细胞。其总的成熟时间约需4~5天。
巨核细胞在成熟过程中,细胞和细胞核的体积不断增大,胞浆内出现大量颗粒,由这种成熟的、带有多核的巨核细胞的胞浆中脱落下来的碎片就是血小板,它们通过骨髓中的血窦进入外周血。血小板首先在脾内停留二天左右,这种血小板不能与循环血小板交换,以后再进入血循环。骨髓中巨核细胞数量的多少直接关系到外周血中血小板的生成数量。巨核细胞在正常人骨髓有核细胞中的比例<1%。正常人每公斤体重的骨髓中含有6×10
 个巨核细胞,每个巨核细胞约能释放2,000~7,000个血小板。
个巨核细胞,每个巨核细胞约能释放2,000~7,000个血小板。血小板大部分(约75%)被体内脾、其次是肝和骨髓的单核-巨噬细胞所吞噬破坏,其余衰老的血小板在循环过程中被破坏。
动物实验示外周血血小板减少,可使巨核细胞数量及体积增加,分裂增多,血小板生成及输出增加;而输入血小板为正常的4~10倍时则可发生相反的改变。上述结果表明,在体内存在着调节血小板水平,改变其生存速率的反馈机理。这种调节作用很可能是通过体液因子起作用的。
在血小板减少症的患者和动物的血浆或尿中都存在着一种能够使正常动物血小板增多的活性物质(血小板生成素thrombopoietin)。血小板生成素可能是一种糖蛋白,主要作用于CFU-S向巨核细胞系定向干细胞分化的阶段,此外也通过影响其成熟速率作用于新形成的巨核细胞本身。由于血小板有吸附血小板生成素的作用,因此它在血中的浓度可随血小板数的增高而降低,继而影响骨髓中血小板的生成速率。
此外,脾脏也起着调节血小板在体内分布与破坏的作用,脾肿大时常伴有血小板的减少。
淋巴细胞的生成、破坏及其调节 淋巴细胞不是一种终末细胞,而是一种不活跃的或处于休止状态的细胞,它具有与抗原起特异反应的能力,称为免疫活性细胞。淋巴细胞可分为胸腺依赖淋巴细胞(参与细胞免疫)和骨髓依赖淋巴细胞(参与抗体生成)两种类型。机体中每日均有一定数量的淋巴细胞消亡,同时又有一定数量的淋巴细胞生成,因而体内淋巴细胞的数量维持着相对的恒定。由CFU-S向淋巴细胞分化需经过淋巴系定向干细胞(eolony forming unit-lymphocyte,CFU-L)阶段。淋巴系定向干细胞并不具有免疫活性。这一类细胞在体内分化为二支。一支经血液到达胸腺,在胸腺素作用下增殖、分化、成熟。其中大部分细胞即在胸腺内死亡,只有1~5%的细胞离开胸腺,成为具有免疫活性的T淋巴细胞而定位于淋巴结的副皮质区和脾脏的中央动脉周围。另一支则在腔上囊或其相当器官(如“肠淋巴样组织”)的影响下定位于淋巴结的生发中心和髓质以及脾脏的生发中心和红髓,称为B淋巴细胞。
淋巴系统由淋巴细胞及网状结缔组织组成。从发育与功能的角度出发,淋巴系统可分为干细胞池,初级淋巴器官和次级淋巴器官三个部分。
(1)干细胞池: 出生后淋巴系统的干细胞来源于骨髓CFU-S,可通过血流至淋巴系统的各个器官。在胸腺分化为T淋巴细胞,在腔上囊或其相当器官则分化为B淋巴细胞。为了保持淋巴细胞的不断生成,维持机体淋巴细胞数的相对恒定,干细胞必须不断增殖并自我更新以保持干细胞库的恒定。
(2)一级淋巴器官(中枢淋巴器官): 包括胸腺、腔上囊或骨髓为淋巴系定向干细胞聚集之所,在此分化、增殖成为淋巴细胞,并向远处部位输送。
(3) 二级淋巴器官(外周淋巴器官): 包括淋巴结、脾脏、消化道及呼吸道粘膜下的淋巴组织,是已分化了的T淋巴细胞和B淋巴细胞集中的器官,其功能并不依赖于初级淋巴器官的存在。
血液中的淋巴细胞只是代表过渡池中的细胞,并不反映全身淋巴细胞总量。据测定,人胸导管引流在最初60天可取得3.5×1011淋巴细胞,以后约每天生成0.8×109个。由于这些淋巴细胞只代表淋巴细胞的一部分,因此成人淋巴细胞总数可超过1012,或总重1kg以上,约占人体重的1.5%。
骨髓中的淋巴细胞大部分为典型的小淋巴细胞,主要由骨髓的造血干细胞生成,其中还包括CFU-S和CFU-L。另有小部分来自胸腺等部位。骨髓淋巴细胞的生成十分活跃,新形成的细胞在骨髓内显示迅速的增殖并部分成熟,而且其生成并不需要抗原的刺激,也不依赖于外周淋巴器官的改变。骨髓内淋巴细胞对胸腺嘧啶核苷的再利用率很高,反映了这些淋巴细胞大部分是“无效”生成,亦即在它们还未离开其产生处所之前即在原位死亡解体,从而提供了子代淋巴细胞DNA合成的原料。
骨髓中的干细胞在没有抗原刺激的情况下,在24~48小时内分化为抗体生成细胞前体。在骨髓中生成的淋巴细胞大部分是免疫上不成熟的无标记(null)细胞。骨髓淋巴细胞成熟为B淋巴细胞的过程开始于骨髓,在外周组织中逐渐完成。B淋巴细胞成熟的标记为膜表面免疫球蛋白(IgM、IgD、IgG)、补体(C)和受体Fc受体的依次出现以及成熟为浆细胞后Ig的分泌等。
胸腺: 胸腺的淋巴细胞早在胚胎时期即由骨髓造血干细胞迁移而来,这种迁移终生都可发生,但在成年期明显减少。在胸腺中,维持淋巴干细胞增殖所需要的造血干细胞数目较少,因而在到达胸腺后,可能进行了多次连续的增殖。胸腺是体内淋巴细胞生成非常活跃的地方。胸腺皮质部淋巴细胞的有丝分裂率较其他外周淋巴器官高5~10倍。胸腺小淋巴细胞系通过其中占10%的中淋巴细胞和大淋巴细胞的分裂而生成。
在新生和成年小鼠,增殖的胸腺淋巴细胞DNA合成期约为6.5~7.0小时,增殖时约9.5小时。几乎绝大部分在胸腺生成的淋巴细胞在原位死亡。只有1~5%的细胞或通过输出淋巴管或直接进入胸腺静脉而离开胸腺。从胸腺输出的淋巴细胞以后可在淋巴结、脾和肠淋巴组织中被发现,其中包括许多寿命长的细胞,能从血至淋巴再循环。
由胸腺生成的T淋巴细胞是由种植在胸腺的干细胞在胸腺环境中进行分化而开始的。在成熟过程中约经6~8次分裂,逐渐从皮质向髓质迁移,同时伴有细胞表面抗原的改变,细胞进入循环或淋巴管后在外周淋巴组织进一步成熟,在抗原作用下变为抗原激活的T细胞,并增殖为各种效应细胞亚群。
外周淋巴结构: 淋巴结、脾及其他外周淋巴结构中的淋巴细胞生成与胸腺及骨髓明显不同。这些组织分担了对抗原反应的功能,并最终完成免疫反应。脾脏主要对通过血流到达的抗原起反应。肠道淋巴组织则对从肠道来的抗原起反应,而淋巴结则通过对来自许多组织,特别是皮肤表面经输入淋巴管而到达的抗原起反应。
在外周淋巴结构中,淋巴细胞的生成发生于淋巴滤泡的生发中心和其他区域。脾脏淋巴滤泡中大部分新生成的细胞似乎也在原位解体死亡。淋巴结受抗原刺激可加速淋巴细胞生成,明显增加新细胞的数量,并经输出淋巴管而流出。在淋巴结中被刺激分裂的细胞,依其刺激抗原的性质,可以是胸腺或非胸腺依赖细胞或二者兼有。据推算,一个正常腋窝淋巴结每小时可产生0.5×106个细胞,但受皮肤同种异体移植抗原刺激后,可增加至2.6×106个细胞。这种产量的提高是由于细胞生成增加而不是由于增殖时间缩短所致。
除生发中心外,其他部位也有明显的淋巴细胞生成。分裂的细胞一般在脾脏和淋巴结的胸腺依赖区,受引起迟发性超敏反应的抗原,特别是移植抗原等的刺激而明显增加。经过几次细胞分裂以后,最终生成小淋巴细胞的新一代。
从皮质淋巴滤泡生发中心的数目以及髓质部浆细胞的浓度来判断,全身淋巴结似乎都处在活动之中,以肠道淋巴组织的生发中心最为活跃。
外周血的淋巴细胞: 外周血的淋巴细胞虽然形态上都属于小淋巴细胞,但实际上都包含了不同来源、大小、寿命、迁移方式、免疫特性和不同超微结构特点的细胞群体。
正常哺乳动物的外周血淋巴细胞分裂指数很低,其中只有少量的淋巴细胞处于增殖周期中,而胸导管内淋巴细胞的分裂指数稍高于外周血,淋巴液中各种细胞大小的多样性分布较血液中所见更为明显,处于活跃的淋巴细胞较血液中的为多。外周血中的小淋巴细胞大多有很长的寿命,受抗原刺激转化后的淋巴细胞,在性质和形态上都和转化前的细胞明显不同。正常人存在着二类淋巴细胞群。20%的细胞平均寿命3~4天,其余的平均寿命为100~200天。某些小淋巴细胞可生存1.5~20年之久。
淋巴细胞被抗原激活后可转化为其他细胞类型。如B淋巴细胞转化为浆细胞前体; T淋巴细胞转化为大型嗜派若宁细胞而参与免疫反应。此时,淋巴细胞的寿命决定于所遇到抗原的机会及对抗原的反应。对于来自肠道的淋巴细胞,由于早期即和抗原相遇和反应,因此寿命短促。对于未能与适合抗原相遇的淋巴细胞最后可消耗而死亡。但淋巴细胞破坏的场所还不很清楚。在淋巴组织中,特别是胸腺和淋巴滤泡的生发中心,可发现有淋巴细胞的破坏,表现为巨噬细胞内吞噬有许多淋巴细胞的核碎片。此外,淋巴细胞破坏的另一个可能场所是消化道的肠腔。
淋巴细胞的再循环: 从淋巴管二个主干进入静脉的淋巴细胞存在着从血至淋巴广泛的再循环现象。这种淋巴细胞是经过淋巴结的输出淋巴管进入胸导管,由胸导管回到血流再回到淋巴结,这种现象被称为淋巴细胞的再循环。它具有加强免疫反应,充实淋巴组织,并可使进入体内的抗原与抗原反应细胞广泛接触的作用。这种血液-淋巴-血液的再循环可以重复进行。达数百次之多。淋巴细胞的再循环主要见于直接参与免疫反应的器官内,参与再循环的淋巴细胞群体主要是T淋巴细胞,并不包括造血干细胞。
有关影响淋巴细胞生成的调节因素目前还了解得很少。控制体内淋巴细胞总量的主要因素与所接触抗原的数量密切相关。此外,下列因素亦能影响淋巴细胞的生成。
动物进食后肠道的淋巴结增大,突出于粘膜表面,分裂细胞增多,而长期饥饿可使生发中心完全消失,髓索和淋巴窦的淋巴细胞数目减少。
多种内分泌因素与淋巴组织的生成有关。胸腺在应激状态下体积可以出现急速缩小。血中肾上腺皮质激素水平和骨髓、淋巴结、胸腺内淋巴细胞分裂指数呈相反的现象。人的胸腺和淋巴结在肾上腺功能不足时容积也增加。肾上腺皮质激素对T细胞的前体细胞及未成熟B细胞的溶解作用或抑制功能较强,对成熟的T、B细胞及浆细胞的影响较小。垂体切除后胸腺萎缩,特别是迅速分裂的皮质细胞改变尤为明显,而投予生长激素,上述情况又可逆转,并使淋巴器官和胸腺重量增加。甲状腺增生的患者,血清中免疫球蛋白增高,淋巴结肿大。正常动物在切除甲状腺后,细胞与体液免疫功能都大为减弱。睾酮也有加速骨髓和胸腺淋巴细胞转变为T淋巴细胞的作用。胸腺素(thymosin)具有调节机体细胞免疫能力的作用。去胸腺动物短时间内可见血和淋巴组织中淋巴细胞明显减少,并失去细胞免疫和对某些抗原的体液免疫反应能力。目前已从牛胸腺中纯化了二种在化学和生物学性质上很相似的多肽——胸腺生成素(thymopoietin) I和II。此外还分离出一种无种属特异性的能诱导T淋巴细胞分化的胸腺多肽,这种胸腺多肽同时也能诱导B淋巴细胞的成熟。
近年来注意到巨噬细胞具有分泌调整各种免疫功能参数的淋巴细胞刺激物的作用。在巨噬细胞培养液中,含有一种致分裂活性的因子。它不仅能刺激胸腺细胞的分裂,并能增加它们对植物血凝集素的效应。它还能诱导T淋巴细胞的成熟,使未成熟胸腺细胞发育为成熟的胸腺细胞。
此外,还发现脾脏能释放一种单一抑制淋巴细胞生成的体液因子——“淋巴细胞抑素”。当切脾后,可见淋巴细胞增多并伴有骨髓小淋巴细胞比例的升高,表明正常时由脾释放的体液抑制因子解除后加速了淋巴细胞的生成。
- 整理资料是什么意思
- 整理选择是什么意思
- 整理阶段是什么意思
- 整理,使有条理是什么意思
- 整理,整顿是什么意思
- 整瓦瓦儿是什么意思
- 整瓶不摇半瓶摇是什么意思
- 整瓶不摇半瓶摇。是什么意思
- 整生是什么意思
- 整生日是什么意思
- 整生日儿是什么意思
- 整田草是什么意思
- 整甲缮兵是什么意思
- 整番齐是什么意思
- 整病是什么意思
- 整着是什么意思
- 整着脸儿是什么意思
- 整着(个)脸子是什么意思
- 整瞻是什么意思
- 整短手杆是什么意思
- 整石斧是什么意思
- 整砖是什么意思
- 整社是什么意思
- 整秋子是什么意思
- 整租是什么意思
- 整秦是什么意思
- 整端是什么意思
- 整箱是什么意思
- 整箱交接是什么意思
- 整箱最低运费是什么意思
- 整箱货是什么意思
- 整箱货最高运费是什么意思
- 整篓洒油,满地拣芝麻是什么意思
- 整篓洒油,满地捡芝麻是什么意思
- 整篓洒油,满地捡芝麻——大处不算小处算是什么意思
- 整篓洒香油,满地拣芝麻——大处不算小处算是什么意思
- 整篓洒香油,满地捡芝麻是什么意思
- 整米是什么意思
- 整米率是什么意思
- 整系数一元n次方程的有理根是什么意思
- 整纷剔蠹是什么意思
- 整经是什么意思
- 整经工是什么意思
- 整经机是什么意思
- 整给是什么意思
- 整缉是什么意思
- 整编是什么意思
- 整编七十四师是什么意思
- 整编复员中的政治工作是什么意思
- 整编师是什么意思
- 整罗是什么意思
- 整置是什么意思
- 整羊席是什么意思
- 整羊席的婚礼是什么意思
- 整群抽样是什么意思
- 整群抽样法是什么意思
- 整群抽样误差是什么意思
- 整群随机抽样是什么意思
- 整翮是什么意思
- 整翻船是什么意思