血红蛋白hemoglobin,Hb
高等脊椎动物和部分无脊椎动物红细胞中含有红色素(血红素)的一种结合色蛋白,是构成红细胞的主要成分。在哺乳动物红细胞中血红蛋白占可溶性蛋白质的95%,它由珠蛋白和辅基亚铁血红素组成。珠蛋白是由两条α-链(亚基)和两条β-链(亚基)组成的四聚体。大多数哺乳动物其α-链由141个氨基酸残基组成,β-链由146个氨基酸残基组成。血红蛋白的每一条多肽链与一个亚铁血红素分子结合,所以每一分子血红蛋白含有四个亚铁血红素辅基。
血红蛋白的主要功能是运输氧和二氧化碳,以及缓冲血液的pH。运输氧和二氧化碳的功能与血红蛋白结合氧呈S形曲线和布尔(Bohr)氏效应这两个特性有密切关系。血红蛋白的氧结合曲线呈S形,是由于其与氧的结合呈现协同效应(协作效应)。就是说,血红蛋白与氧结合的亲和力因血红蛋白与氧结合的量而异,结合量越大,亲和力越大,或者说带氧的血红蛋白分子协助不带氧的分子结合氧。血红蛋白的效应是通过血红蛋白的变构效应来实现的。S形曲线的生理意义,是动物可以在一定较宽的氧浓度范围内结合或释放氧,使一种动物在不同氧分压条件下,或各种动物根据不同生活方式来回移动S曲线,以适应外界氧分压的差异,更有利于氧在肺部的结合和在组织的释放,使它能更有效地担负运输氧的作用。
CO2分压对血红蛋白结合氧的亲和力有影响,也就是说CO2分压增加,氧亲和力下降,同时也发现血红蛋白的氧亲和力随着pH降低而降低。人们把这一具有重要意义的生理现象叫Bohr效应。这一发现揭示了细胞的氢离子浓度是调节血红蛋白功能的一个重要因子。如当血液流经组织时,由于组织产生CO2及一些酸性代谢产物使pH降低,血红蛋白和氧亲和力减弱,使氧合血红蛋白的解离加强,更多地释放氧; 而在肺部正好反过来,结合氧,释放CO2与H+。血红蛋白还可直接与CO2结合生成氨基甲酸化合物,在CO2的运输上起重要作用。血红蛋白的另一个重要作用,是缓冲血液的pH。在组织中氧合血红蛋白释放1分子氧的同时,结合1个氢离子,以补偿由于呼吸作用形成的CO2引起的pH降低。红细胞中,2,3-二磷酸甘油酸(DPG)也是调节血红蛋白对氧亲和力的重要因素。DPG可与许多哺乳动物的血红蛋白可逆的结合。血红蛋白结合DPG以后其构像发生变化,降低了结合氧的能力,S形曲线右移,但在血液通过肺时,因氧分压高,DPG的影响不大,当血液流经组织时,DPG 则显著地增加氧的释放,供应组织的需要。
血红素是一种含铁的卟啉,卟啉是原卟啉Ⅸ。它的分子式是C38H32O4N4Fe,分子量为616.5。原卟啉是在4个吡咯环上连接有4个甲基、2个乙烯基和2个丙酸基等侧链而成的。原卟啉与亚铁原子(Fe2+)结合即成血红素,又称亚铁血红素。血红素中的亚铁原子位于卟啉环的中心。铁有6个配位键,其中4个配位键在血红素平面与4个吡咯环的氮相联,第五和第六配位键在平面的两侧,第五配位键接在珠蛋白肽链的组氨酸咪唑基的N上,第六配位键可与氧 (或其他化合物)相结合,在此邻近处有肽链的另一个组氨酸残基。原卟啉结构、血红素结构和血红素Fe2+的配位关系如图所示。
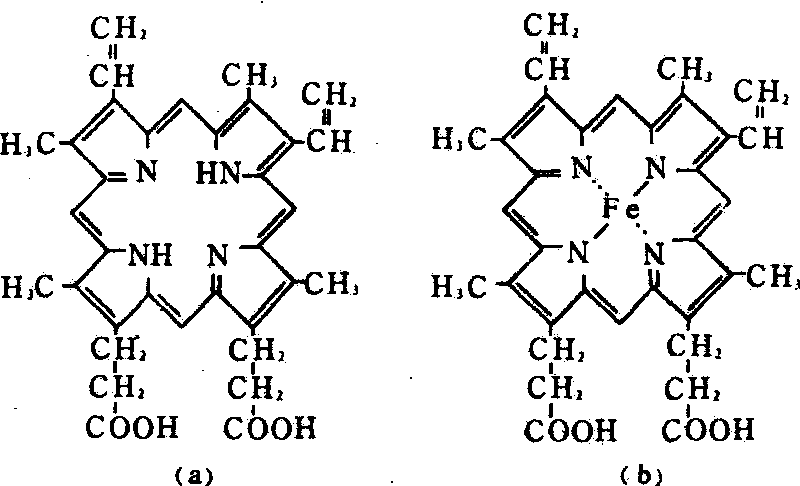
血红素结构
(a)原卟啉结构; (b)血红素结构(c)血红素Fe2+的配位关系
血红素中的铁原子通常是二价(Fe2+),只有二价铁的血红蛋白(亚铁血红蛋白)才能与氧结合; 血红素中的铁原子必须与珠蛋白中的组氨酸咪唑基的N结合后才能起到运输氧的作用,单独的血红素不能载氧:血红素与珠蛋白联结后,在结合氧时,铁原子(Fe2+)自身不被氧化,游离的亚铁血红素虽然自身也可以结合氧,但亚铁很快被氧化成正铁状态,失去了运输氧的功能。这些是血红素中铁原子与氧结合的重要特性。
血红蛋白haemoglobin
血红素与珠蛋白结合而成的一种载氧有色蛋白。珠蛋白由两条α和两条β多肽链所组成,每条链以配价键形式与血红素分子相连。血红素内含铁离子,可与氧和二氧化碳分子可逆地结合和分离。存在于人和脊椎动物的血液中,起运送氧和运出二氧化碳气体以及缓冲血液的pH作用。也存在于酵母、草履虫、蠕虫、昆虫等低等动物体液中,起贮氧作用。豆科植物根瘤中的血红蛋白,称为豆血红蛋白,由于它与氧的亲和力高,从而使根瘤中固氮酶的周围形成一个低氧的环境,以此保证固氮反应顺利进行。
血红蛋白xuehongdanbai
红细胞中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。分子量约64,500,其中蛋白质占96%。血红素由二价铁原卟啉组成。球蛋白由两对不同肽链组成。每个肽链含1个血红素分子,所以1个血红蛋白分子能结合4个氧分子。正常人血红蛋白(Hb)含血红蛋白A (HbA)、血红蛋白A2(HbA2)及血红蛋白F (HbF)。HbA由一对α链及一对β链构成(α2β2),约占成人血红蛋白的97%。HbA2由α链及δ链组成(α2δ2),占成人血红蛋白的2~3%,HbF又称胎儿血红蛋白,由α链与γ链组成(α2γ2),占胎儿时血红蛋白的60~90%,成人时不超过1%。结构与上述几种不同的血红蛋白称异常血红蛋白,目前发现的已超过300种,但并不都表现为明显的疾病。血红蛋白的主要生理功能是运输氧和二氧化碳及调节血液的酸碱平衡。血红蛋白能与氧迅速结合成氧合血红蛋白(HbO2),也能迅速解离。其结合与解离取决于血液中氧分压的高低,当血液流经肺部时,氧分压增高,使得大部Hb与O2结合成HbO2;血液流经组织时,氧分压下降,一部分HbO2解离,释放出O2,供组织利用。血液对CO2运输的机制比较复杂,其一是当血液流经组织时,CO2分压升高,Hb可以与CO2结合成氨基甲酸血红蛋白,到肺部时释放出CO2,而又与O2结合,如此循环,这是一个非常复杂的物理、化学反应过程。如果Hb上的铁被氧化成三价铁,则所结合氧不易分离,失去带氧能力。此外,Hb也能与CO结合,其与CO的亲合力比O2大约200倍,所以空气中只要有少许CO存在,即可有大量HbCO,而使HbO2下降、产生窒息,即煤气中毒。血红蛋白浓度与红细胞数目有关。我国成年男子Hb为120~160克/升,女子为110~150克/升。贫血时红细胞与Hb都减少,下降程度与疾病及其严重程度有关。红细胞破坏后,Hb就降解成其它物质,所以血红蛋白的生理功能只能在红细胞内完成,游离到血浆中后即失去作用。
血红蛋白hemoglobin
系组成红细胞的重要成分。正常成年人男性为130~160g/L(13~16g/dL),女性为110~150g/L(11~15g/dL)。对体内氧及二氧化碳运输有重要意义。临床检验血红蛋白增高,见于真性红细胞增多症、代偿性红细胞增多症、各种原因引起的脱水等;减少,见于各种贫血。
血红蛋白Xuehong dan bai
红细胞中的主要成分,属于结合蛋白,由珠蛋白和一种含两价铁原子的色素(血红素)结合而成。正常成年男子每升血液中含血红蛋白120—160克; 女子为110—150克/升。初生婴儿的血红蛋白含量较高,随后逐渐下降,儿童期最低,至青春期后,增到成人水平。贫血时,血红蛋白含量常表现为降低。
血红蛋白的主要机能是运输氧和二氧化碳, 其特点是:在氧分压高的地方,与氧结合增加(如肺泡内的气体交换);在氧分压低的地方,释放氧,供组织细胞代谢的需要。血红蛋白与氧的结合是一种可逆过程,称为氧合作用。血红蛋白的功能只有在红细胞内才能实现(如果红细胞破裂,血红蛋白释放到血浆中,就丧失了其作用。血红蛋白还能与一氧化碳结合,其亲和力比氧大200倍,空气中只要有很少量的一氧化碳存在,体内就会有大量血红蛋白与之结合, 与氧结合的血红蛋白将减少,机体会出现缺氧症状,严重的发生窒息(这就是造成煤气中毒的原因)。急救时,要迅速打开门窗,将中毒者抬到空气新鲜处, 松解衣裤, 保持呼吸道通畅,同时注意保暖。若呼吸停止,心脏停搏,则要进行人工呼吸和心脏胸外挤压。
血红蛋白
含铁的复合蛋白。由血红素和珠蛋白结合而成。红细胞的主要成份。向组织输送氧气并将组织的二氧化碳运送到肺进行气体交换。成年男性血红蛋白浓度12—16升/100毫克血液;女性11—15克/100毫升血液。参见“生物”中的“血红蛋白”。
血红蛋白
简称“Hb、HHb”。一种最简单的寡聚蛋白质,由2条α-链和2条β-链组成,是一个含二种不同亚基的四聚体,每条链环绕着一个亚铁血红素基团,外形呈结实的近似球状的结构。在血液中起运输氧和二氧化碳的作用,是一种呼吸蛋白,
血红蛋白
是一种含铁的复合蛋白,由血红素和珠蛋白结合而成的,是红细胞的主要成分。正常人血红蛋白的含量与红细胞数量成正比,即红细胞数量多,其血红蛋白含量也高。我国成年男子每100毫升血液中,血红蛋白的含量约12~15克,成年女子约11~14克。如果每100毫升血液的血红蛋白男子低于12.5克,女子低于11.5克即为贫血。在老年人中约有10.8%的男子和15.7%的女子有贫血现象。血红蛋白的主要功能是运输氧和二氧化碳,此外对血液酸硷度还可起缓冲作用。血红蛋白只有存在于红细胞中才能发挥其作用,如果红细胞破裂或溶解,使血红蛋白逸出,则其功能即丧失。
血红蛋白hemoglobin
是红细胞的主要成分,由人体有核红细胞及网状红细胞合成的一种色素蛋白和血红素辅基两部分组成。它具有与氧分子呈可逆性结合的功能,是人体内氧的运输和交换戴体。血红蛋白超过正常,示有真性红细胞增多症、代偿性红细胞增多或相对性红细胞增多的可能。血红蛋白减少见于各种贫血。
血红蛋白
血红蛋白(Hb) 是红细胞最主要的成分,其含量约占红细胞干重的97%,是红细胞运输氧和部分二氧化碳的载体。它是首先被结晶提纯,测得精确的分子量。并通过X光衍射晶体学结构分析阐明分子结构,从而对其结构与功能关系进行研究的蛋白质。
血红蛋白的基本结构 血红蛋白是由珠蛋白和辅基血红素所组成的一种色蛋白。
血红素是亚铁离子与原卟啉Ⅸ的络合物。络合分子是扁平状,呈红色,结构如下: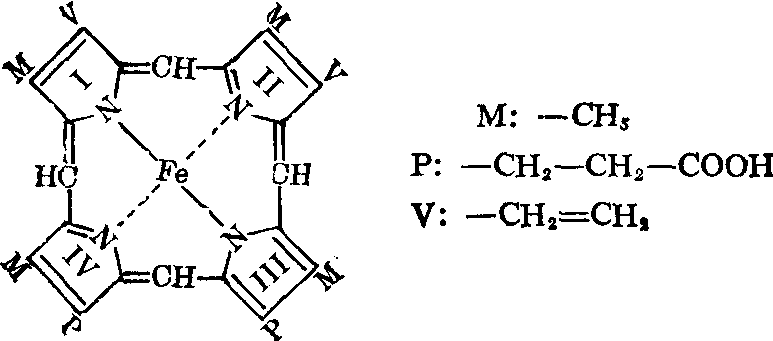
如图所示,铁原子位于卟啉环的中央,分别与卟啉环内两个氮原子以共价键相连,另两个氮原子以配位键相连。此外,又在与卟啉环平面成直角的方向,在卟啉环平面的一侧与珠蛋白中组氨氮酸咪唑基上的氮原子形成配位键,在卟啉环平面的另一侧还有一配位键可与O2、H2O或其他配基形成配位结合并可进行可逆的解离。

图1 人血红蛋白β亚基的一级结构
与血红素相连的珠蛋白由四条肽链构成,每条肽链和一个血红素结合组成一个血红蛋白亚基。血红蛋白分子由四个亚基组成。正常成年人红细胞中的血红蛋白有三种: HbA1 (α2β2)占97%,HbA2(α2δ2)占2%,HbF(α2γ2)占1%。它们分别由两个α亚基与两个β、δ或γ亚基所组成。α亚基由141个氨基酸组成而β、γ、δ亚基则各由146个氨基酸组成。四种亚基的氨基酸排列顺序业己完全阐明,图1示β亚基的一级结构。虽然各种亚基的氨基酸顺序不尽相同,但肽链的空间结构相仿,都有约75%的α-螺旋结构,并在此基础上盘绕成A、B、C、D、E、F、G、H八个α螺旋肽段。各螺旋肽段由长短不一的非螺旋区AB、BC、CD、DE、EF、FG、GH相联。这些非螺旋肽段均含有脯氨酸残基,肽链通常在此处发生弯曲而形成一定的空间构象,并依靠螺旋肽段间的氢键或离子键维持分子构象的稳定。屈曲盘绕后的肽链,亲水基团常暴露在外,而疏水基团都分布在亚基内部,这样既保证了血红蛋白分子的高度可溶性,同时又为血红素创造了一个防止亚铁原子氧化所必需的疏水环境。血红素即埋藏在主要由含疏水侧链的氨基酸残基所包围而成的袋穴中,只有卟啉环上两个丙酸基的侧链自袋口伸向周围。在血红素环平面的两侧各有一个组氨酸咪唑基。 F
 组氨酸残基(α链的第87位或β链的第92位组氨酸)离血红素平面较近,称近心组氨酸,而E7组氨酸残基(α链的第58位或β链的第63位组氨酸)则距离较远,称远心组氨酸(图2)。血红素一方面通过其铁原子与F8组氨酸咪唑基氮间的配位键相连, 另方面由卟啉环与E
组氨酸残基(α链的第87位或β链的第92位组氨酸)离血红素平面较近,称近心组氨酸,而E7组氨酸残基(α链的第58位或β链的第63位组氨酸)则距离较远,称远心组氨酸(图2)。血红素一方面通过其铁原子与F8组氨酸咪唑基氮间的配位键相连, 另方面由卟啉环与E 、F、CD肽段的疏水侧链通过疏水键相连。在血红素铁与E7组氨酸咪唑基间有一细小的空隙,当血红蛋白与氧相遇时,铁原子通过第六配位键在此空隙与氧分子结合形成氧合血红蛋白。
、F、CD肽段的疏水侧链通过疏水键相连。在血红素铁与E7组氨酸咪唑基间有一细小的空隙,当血红蛋白与氧相遇时,铁原子通过第六配位键在此空隙与氧分子结合形成氧合血红蛋白。
图2 血红蛋白β亚基的三级结构示意图
P: 丙酸基
四个血红蛋白亚基又组成一个四面体式的对称的球状血红蛋白分子。两α亚基或两β亚基间的接触甚少,但α亚基与β亚基间则有较大面积的接触。α1与β1(或α2与β2)间的接触涉及α链和β链的G10到H9之间以及B和D肽段约35个氨基酸残基的侧链,共可形成17~19个氢键,因此使α1与β1(或α2与β2)亚基紧紧相连构成一稳定的αβ二聚体。但α1与β2,(或α2与β1)亚基间的接触则较前者为少。只包括FG和CD肽段的19个氨基酸残基的侧链,因此α1与β2(或α2与β1)间的接触没有α1β1(或α2β2)间的广泛牢固,当血红蛋白解聚时容易解离为两个对称的α1β1及α2β2二聚体。
血红蛋白的理化性质见下表:
表1 正常人血红蛋白的理化性质
| 铁含量(%) 氮含量(%) 最小分子量(根据铁含量分析) 珠蛋白分子量(按氨基酸分析) 血红蛋白分子量(根据不同方法) 沉降常数S020, W(Svedberg单位) 扩散常数107cm2sec-1 微分比容 等电点 分子大小 | 0.335 16.9 16,700 64, 450 64, 450~68, 000 4.35~4.45 6.0~6.4 0.749 pI6.8 55×64×50nm3 |
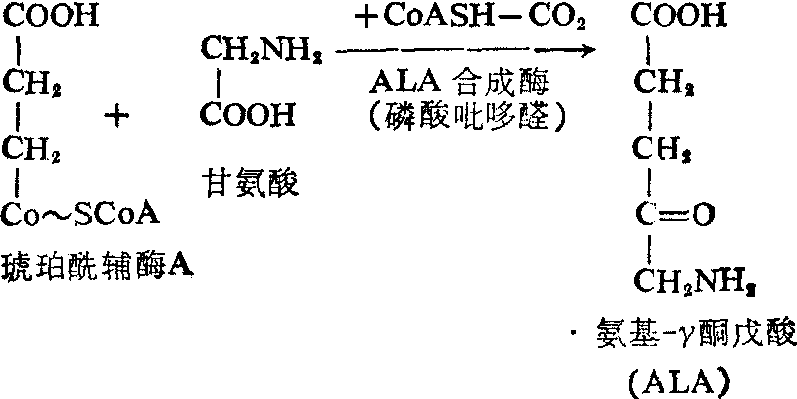
血红素的生物合成 血红蛋白是由珠蛋白与血红素所构成。珠蛋白的生物合成与一般蛋白质相同,此处不再赘述。体内由铁、甘氨酸和琥珀酰辅酶A合成血红素的过程如下:
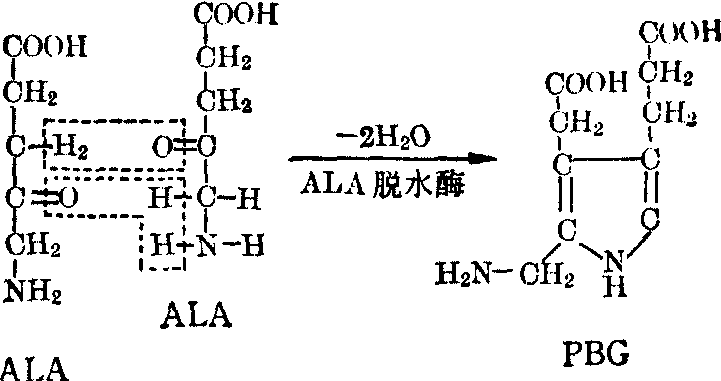
δ氨基-γ酮戊酸(ALA)的生成 在线粒体内,琥珀酰CoA与甘氨酸在δ-氨基-γ酮戊酸合成酶(ALA合成酶)的催化下脱羧并缩合生成ALA。磷酸吡哆醛是ALA合成酶的辅酶。
卟胆原(PBG)的生成 ALA转出线粒体外,在ALA脱水酶的催化下,两分子ALA缩合生成一分子卟胆原。
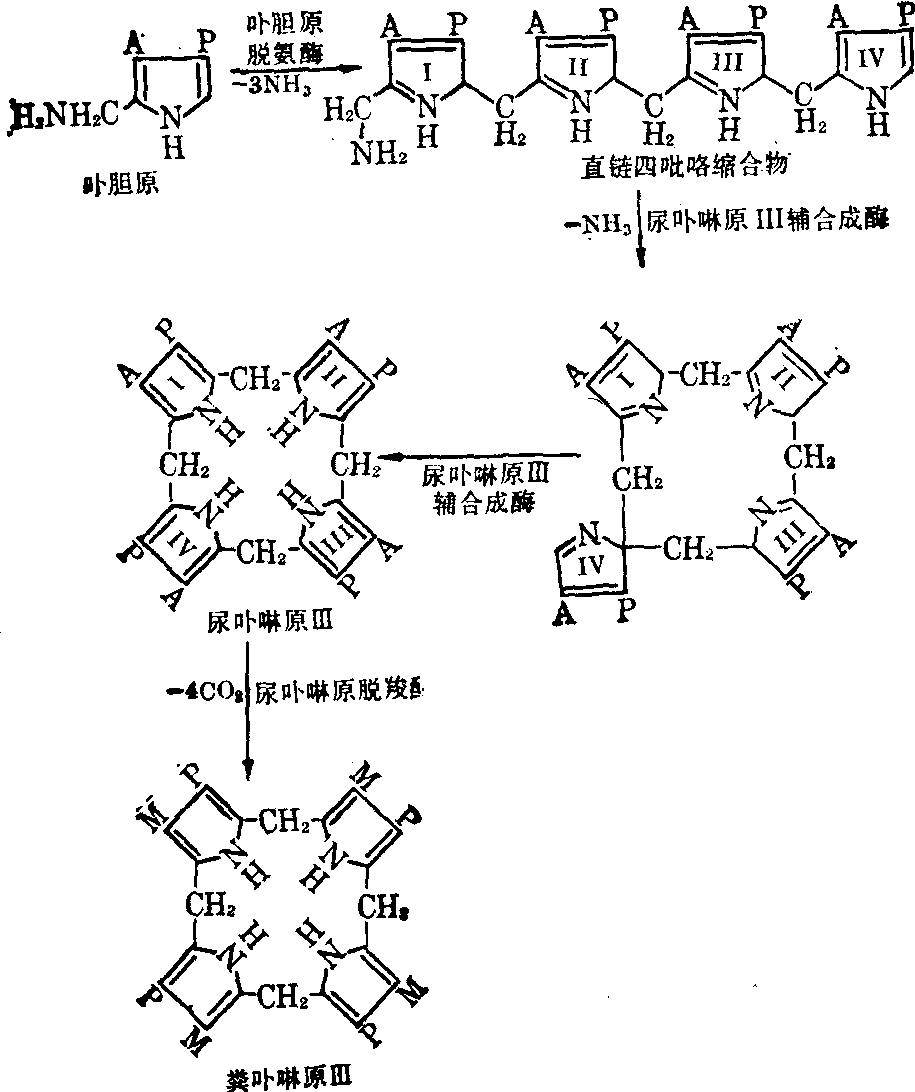
粪卟啉原Ⅲ的生成 在细胞浆内,卟胆原在卟胆原脱氨酶作用下,脱氨生成直链四吡咯缩合物。后者在尿卟啉原Ⅲ辅合成酶催化下经一系列过程生成尿卟啉原Ⅲ,首先Ⅰ、Ⅳ吡咯环脱氨缩合环化,继而Ⅲ、Ⅳ吡咯环间的连接键断开,经互变异构后又重新环合,最后生成尿卟啉原Ⅳ。后者经尿卟啉原脱羧酶作用脱羧生成粪卟啉
血红素的生成 粪卟啉原重新进入线粒体内,在供氧条件下,经粪卟啉原氧化脱羧酶的作用氧化脱羧生成原卟啉原Ⅸ,再在原卟啉原氧化酶作用下氧化生成原卟啉区。后者在线粒体内膜上经亚铁络合酶的催化与Fe2+螯合生成血红素。
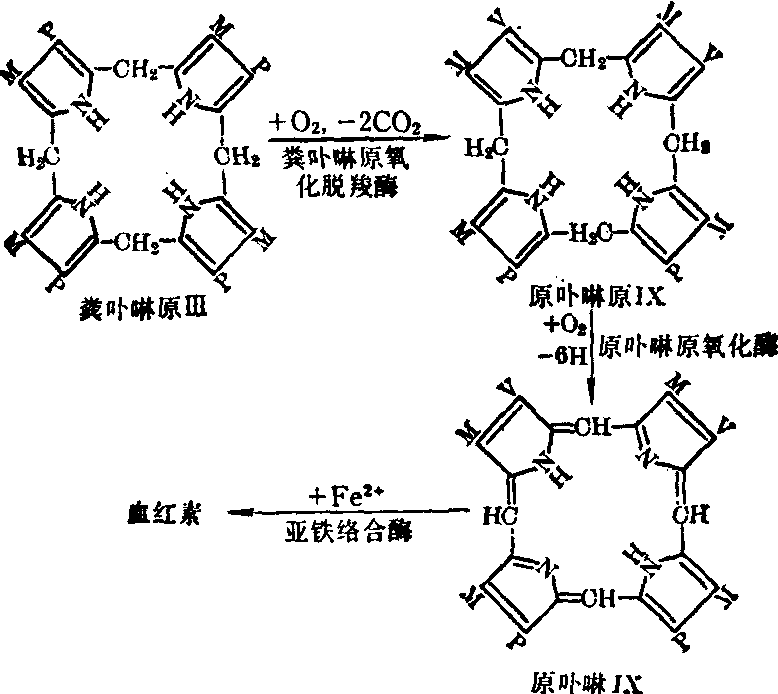
血红素合成后迅即透出线粒体膜与珠蛋白结合生成血红蛋白。
血红素合成过程中,ALA的合成以及最后由粪卟啉原Ⅲ合成血红素的过程都在线粒体内进行,人体成熟红细胞不含线粒体,因此没有合成血红素的功能。成熟红细胞中的血红素是在早幼红细胞至网状红细胞阶段合成的。正常人体骨髓细胞每天约合成血红素210mg,主要用于血红蛋白的更新。正常人每天约合成血红蛋白6g。
在血红素合成过程中,ALA合成酶是限速酶,它的活性受体内外多种因素调节,例如可为血红素所抑制,促红细胞生成素所促进。睾酮的代谢物,5β氢睾丸酮以及巴比妥类、磺胺类、苯妥英钠、利眠宁等致卟啉药物能诱导该酶的生成。
维生素B12因是单数碳原子的脂肪酸或某些氨基酸氧化生成的丙酰辅酶A转变生成琥珀酰辅酶A所必需的辅酶,因此也与血红素的合成有关。
血红蛋白(脱氧血红蛋白)的衍生物
氧合血红蛋白与氨基甲酸血红蛋白 见 “血红蛋白在气体运输中的作用”条。
一氧化碳血红蛋白 血红蛋白可与一氧化碳结合形成一氧化碳血红蛋白(HbCO),其结合部位也是血红素铁的第六配位键。
Hb+CO—→HbCO
血红素与CO的结合甚为牢固,较与O2的结合力大150倍,因此当血红蛋白与CO结合后,就失去带氧能力。只要空气中的CO含量达千分之一时,即可使血液中半数的血红蛋白结合形成HbCO,造成组织缺氧,甚或死亡。而且,当CO与血红蛋白分子中任何一亚基结合后,还能大大提高其余三个亚基与氧的亲和力,使氧解离曲线左移(见“血红蛋白与气体运输”条),氧的释放因而大为减少,更加重缺氧的严重性。
HbCO呈樱红色,其吸收光谱(表3)可作为临床诊断的依据。
在氧分压高或与氧充足的空气接触时,HbCO也可恢复成氧合血红蛋白 (HbO2),故可用纯氧或高压氧抢救CO中毒。
高铁血红蛋白 在氧化剂作用下,血红蛋白分子中的血红素铁可自两价被氧化成三价。带有高铁血红素的血红蛋白即称为高铁血红蛋白(MHb)。不少药物或化合物如硝酸盐或亚硝酸盐、硝基甘油、苯胺类、硝基苯类、磺胺类及醌类化合物均可使血红蛋白在体内氧化成高铁血红蛋白,但在正常红细胞中存在着一系列酶促与非酶促的高铁血红蛋白还原系统 (表2),因此正常红细胞中MHb的含量不到血红蛋白总量的1%。
表2 红细胞中高铁血红蛋白还原系统
| 高铁血红蛋白还原系统 | 占总还原能力的百分比(%) |
| 酶促还原系统 | |
| NADH脱氢酶Ⅰ NADH脱氢酶Ⅱ NADPH脱氢酶 非酶促还原系统 | 61 5 6 |
| 抗坏血酸 谷脱甘肽 | 16 12 |
当机体摄入氧化剂过多,使MHb的生成速度超过MHh还原速度时,可导致红细胞中MHb的增高而产生高铁血红蛋白过多症。MHb的三价铁不能与氧配位结合,失去输氧能力,患者可因缺氧而发生紫绀。临床上所谓的肠原性紫绀就是由于摄入过多硝酸盐或亚硝酸盐类引起的MHb过多的中毒症状。某些病理情况,如遗传性高铁血红蛋白过多症就是由于先天性缺乏NADH-高铁血红蛋白还原酶(即NADH脱氢酶Ⅰ)所致。某些异常血红蛋白,如MHb,因珠蛋白肽链中与血红素邻近的一个组氨酸为酪氨酸所取代,亦可引起血红素Fe2+被氧化而成为高铁血红蛋白。
MHb呈棕褐色,有特殊的吸收光谱(表3),可助诊断。
硫血红蛋白 在正常红细胞中不存在,但当血红蛋白与硫化氢或苯肼等化合物以及上述一些能形成MHb的药物作用后,可变成硫血红蛋白。它的结构是在血红素铁和珠蛋白组氨酸咪唑基间多一个硫原子,一旦形成后即不能再恢复成血红蛋白,且丧失带氧能力,故常出现紫绀。
表3 血红蛋白及其衍生物的吸收光谱
| 血红蛋白及其衍生物 | 最大吸收峰(波长nm) |
| 脱氧血红蛋白(Hb) 氧合血红蛋白(HbO2) 一氧化碳血红蛋白(HbCO) 高铁血红蛋白(MHb) 硫血红蛋白 血红素 | 428~430, 535 412~415, 541, 576~578 417~418,537,568~572 404~407, 500, 540, 578, 630 540.618 550, 575 |
异常血红蛋白 在人体发育的不同阶段,先后出现六种不同的血红蛋白,其分子组成如下:
Hb Portland ζ2γ2
Hb Gower 1 ζ2ε2
Hb Gower 2 α2ε2
HbF α2γ2
HbA1 α2β2
HbA2 α2δ2
组成这些血红蛋白的六种肽链中,除ζ和ε链外,余四种肽链的一级结构业已完全阐明。ζ链有部分结构与α链相似,而ε链则与β链有类似的氨基酸顺序,因此它们可能分别是原始的α及β链。在胚胎早期ζ和ε链首先合成,其后α链和γ链也开始产生,当胚胎发育至第八周时,ζ和ε链逐渐消失而γ链的合成逐渐增多,至胚胎四个月时达最高值,同时β链也开始合成,此后,γ链合成逐渐下降而β链逐渐增多,至出生时γ链和β链的合成速度几乎相等。此后,γ链的产生迅速下降而β链则急剧增多。
因此,在胚胎早期主要为Hb Portland而在胚胎1~4月时则主要为Hb Gower 1及2,四个月的胎儿又以HbF为主,出生后HbF逐渐减少而HbA则逐渐增多。在新生儿HbF占Hb总量的50~90%,一岁时为15%,而至4岁时已降至成人水平(1%以下),正常成人血红蛋白以HbA1为主,此外尚有少量HbA2及HbF。
珠蛋白肽链的合成受αβ、γ、δ等不同等位基因的控制。β、γ和δ基因依次紧靠存在于同一染色体上,而α基因则位于不同的染色体上。根据不同发育阶段基因的开放不同,故表现出不同的血红蛋白。在正常成年人,α、β和δ基因开放,而γ基因则基本上处于关闭状态,因此只能合成α、β和δ链以及少量的γ链。而且α、β和δ链的合成速度又互相适应,不致形成过多的α、β或δ链,所以在成年人红细胞中只有HbA1、HbA2以及少量的HbF。但若某一基因缺失或基因的调节失常,则可使某种肽链不能合成或合成减少以致肽链合成的比例失调,正常亚基不正常地聚合而形成异常血红蛋白。如地中海贫血就是因为常染色体遗传性缺陷引起珠蛋白的一种或几种肽链的合成部分或完全抑制所致。由于β基因的缺失或表现失常,因而不能转录出相应的β链mRNA或仅能转录出一个变异的β链mRNA而引起β链的合成障碍者,称β地中海贫血。此时HbA1减少或缺如,HbA2相对增多,HbF则因γ链的合成代偿性增高而增高。少数情况下,亦可β和δ链的合成均降低而使HbA1及HbA2均明显减少或缺乏。若α基因丢失而引起α链的合成障碍时,称α地中海贫血。此时过剩的β链或γ链可分别聚合成HbH(β4)或Hb Barts(γ4)两种异常血红蛋白。
另一种异常血红蛋白是由于基因缺陷,发生变异而使合成的α链或β链中某一氨基酸被置换或缺失所致。这种类型的异常血红蛋白,在人类已发现近300种。例如,镰刀形贫血症患者的血红蛋白,HbS就是因HbA两条β链中N端第6位谷氨酸为缬氨酸取代所致,而最近在我国广西武鸣地区发现的血红蛋白武鸣则是α链第11位赖氨酸为谷氨酰胺所取代而成。又如Hb Tours则为β链第87位苏氨酸缺失的异常血红蛋白。
此外,尚有少数异常血红蛋白是在肽链中嵌入部分氨基酸残基而成,例如Hb Gardy就是在α链第119位脯氨酸和120位丙氨酸间嵌入了α链第117~119位三个氨基酸残基(苯丙—苏—脯)的异常血红蛋白。
血红蛋白
hemoglobin
血红蛋白
haemoglobin
- 重洋是什么意思
- 重活是什么意思
- 重活儿是什么意思
- 重浊是什么意思
- 重温是什么意思
- 重温旧梦是什么意思
- 重演是什么意思
- 重灾是什么意思
- 重灾区是什么意思
- 重炮是什么意思
- 重点是什么意思
- 重点论是什么意思
- 重熙是什么意思
- 重版是什么意思
- 重物是什么意思
- 重犯是什么意思
- 重现是什么意思
- 重生是什么意思
- 重生父母是什么意思
- 重用是什么意思
- 重申是什么意思
- 重男轻女是什么意思
- 重甸甸是什么意思
- 重睹是什么意思
- 重瞳是什么意思
- 重码是什么意思
- 重磅是什么意思
- 重礼是什么意思
- 重组是什么意思
- 重结晶是什么意思
- 重罚是什么意思
- 重罪是什么意思
- 重聚是什么意思
- 重臂是什么意思
- 重臣是什么意思
- 重茧是什么意思
- 重茬是什么意思
- 重荷是什么意思
- 重行是什么意思
- 重要是什么意思
- 重要性是什么意思
- 重见天日是什么意思
- 重规迭矩是什么意思
- 重视是什么意思
- 重言是什么意思
- 重言式是什么意思
- 重译是什么意思
- 重话是什么意思
- 重读是什么意思
- 重负是什么意思
- 重责是什么意思
- 重赏是什么意思
- 重赏之下,必有勇夫是什么意思
- 重起是什么意思
- 重起炉灶是什么意思
- 重足而立是什么意思
- 重足而立,侧目而视是什么意思
- 重趼是什么意思
- 阴笑是什么意思
- 阴线是什么意思