血浆蛋白质
血浆蛋白质是血浆中一系列不同蛋白质的总称。由于所用分离方法在原理上和分辨力上皆不同,故血浆蛋白质有多种分类。用盐析法(如硫酸铵沉淀法)可将血浆蛋白质分为清蛋白及球蛋白,后者包括优球蛋白及拟球蛋白。用自由电泳或区域电泳(如醋酸纤维薄膜电泳)可将血浆蛋白质分为清蛋白、α1-球蛋白、α2-球蛋白、β-球蛋白、γ-球蛋白及纤维蛋白原。Cohn的分组法是利用低温、不同pH条件下进行盐析并加有机溶剂沉淀,以制备不同的血浆蛋白质。所得Cohn组分为组分Ⅰ (主要是纤维蛋白原),组分Ⅱ(主要为γ-球蛋白)、组分Ⅲ-1、2、3(含纤维蛋白原及凝血酶原等α-及β-球蛋白)组分Ⅳ-6、7(主要为含糖α-球蛋白及与金属结合的β-球蛋白) 组分Ⅴ(主要为清蛋白)及组分Ⅵ(主要为酸性糖蛋白)。用聚丙烯酰胺凝胶电泳,结合免疫学方法及特异染色法,现已将血浆蛋白质分离鉴别出30余种。下表列出含量较多的血浆蛋白质及其性质和作用。
血浆蛋白质在化学组成上除清蛋白几乎全不含糖,是单纯蛋白质外,其它皆为含杂糖链的糖蛋白。有些蛋白质尚与各种金属离子、脂类及其它难溶于水的代谢产物作非共价结合。
血浆蛋白质给予血浆一定的粘滞性,使后者有正常的流动性。它们又构成血浆胶体渗透压,从而维持正常的血容量。血浆蛋白质在血液正常pH下还可组成缓冲对,在保持机体酸碱平衡中起一定作用。此外,他们是与组织蛋白质相互补充的,分解时产生的氨基酸皆归属于体内氨基酸代谢库。更重要的是不同蛋白质各有其主要的生物学功能,例如清蛋白维持血容量的作用;清蛋白、α-及β-球蛋白有运送代谢物作用; 纤维蛋白原及其它球蛋白的凝血及抗凝血作用;γ-球蛋白的免疫防御作用; α-及β-球蛋白的蛋白酶抑制剂作用等。
各种血浆蛋白质的性质和作用
| 名 称 | 电泳 行为 | 分子量 | 沉降常数 S20,W | 等电点 pI | 糖含量 % | 浓度g/L | 生物学功能 |
| 1.前清蛋白 | α0 | 54 980 | 3.9 | 4.7 | 0.5 | 0.28~0.35 | 结合运送甲状腺素 |
| 2.清蛋白 | α0 | 65 000 | 4.6 | 4.7 | 0.03 | 35~45 | 维持胶体渗透压,结合运送一系列离 子、代谢物 |
| 3.α1脂蛋白(HDL) | α1 | 200 000 | 5.0 | — | 1.5 | 2.9~7.7 | 结合运送脂肪、类脂等 |
| 4.α1酸性糖蛋白 | α1 | 40 000 | 3.5 | 2.7 | 41.4 | 0.55~1.4 | “急时相物质” |
| 5.低色氨酸α1糖蛋白 | α1 | 60 000 | 3.3 | — | 13.8 | 0.05~0.12 | 未 明 |
| 6.α1抗胰蛋白酶 | α1 | 54 000 | 3.4 | 4.8 | 12.4 | 2~4 | 蛋白酶抑制剂 |
| 7.α1易沉淀糖蛋白 | α1 | 50 000 | 3.8 | — | 13.3 | 0.15~0.3 | 未 明 |
| 8.皮质素传递蛋白 | α1 | 52 000 | 3.7 | — | 14~26 | 0.03~0.035 | 结合运送皮质素 |
| 9.α1x糖蛋白 | α1 | — | 3.9 | — | 22.7 | 0.4~0.6 | 未 明 |
| 10.α1神经氨酸糖蛋白 | α1 | — | 3.7 | — | 42.6 | 0.15~0.25 | C1S酯酶抑制剂 |
| 11.GC球蛋白 | α1α2 | 50 800 | 3.7 | — | 4.2 | 0.3~0.55 | 未 明 |
| 12.Znα2糖蛋白 | α2 | 41 000 | 3.2 | — | 18.2 | 0.02~0.15 | 未 明 |
| 13.甲状腺素结合球蛋白 | α2 | 58 000 | 3.9 | — | — | 0.01~0.02 | 结合运送甲状腺素 |
| 14.间α抗胰蛋白酶 | α1α2 | 160 000 | 6.4 | — | 8.5 | 0.2~0.7 | 蛋白酶抑制剂 |
| 15.α2HS糖蛋白 | α2 | 49 000 | 3.3 | — | 13.4 | 0.4~0.85 | 功能未明 |
| 16.铜蓝蛋白 | α2 | 150 000 | 7.1 | 4.4 | 8.0 | 0.15~0.6 | 结合运送血清铜,急时相物质 |
| 17.α2巨球蛋白 | α2 | 725 000 | 19.6 | 5.4 | 8.4 | 1.5~4.2 | 蛋白酶抑制剂 |
| 18.胆碱酯酶 | α2 | 300 000 | 12 | — | — | 0.003~0.011 | 水解乙酰胆碱 |
| 19.结合珠蛋白 | α2 | (Hp1-1) 100 000 | (HpH)4.4 6.5.7.5 | 4.1 | 19.3 | 0.5~2.2 | 结合血浆血红蛋白,急时相物质 |
| 20.α2脂蛋白(VLDL) | α2或前β | 5~20 ×106 | Sf>12 | — | 1.7 | 1.5~2.3 | 运输脂类,尤其甘油三酯 |
| 21.β脂蛋白(LDL) | β1 | 3 200 000 | Sf3-12 | — | 1.8 | 2.19~3.4 | 运送脂类,主要磷脂、胆固醇 |
| 22.β2糖蛋白Ⅲ | β | — | — | — | — | 0.072 | 未 明 |
| β1C球蛋白 23.β1A球蛋白 | β1 | ~ 75 000 | 9.5 — | — — | 3.0 — | 0.8~1.4 — | 新鲜血中存在,是补体第3成分C3, 田β1C分解产生A及D |
| 24.铁传递蛋白 | β | 76 500 | 5.3 | 5.5 | 5.8 | 2~3.2 | 结合运送血清铁 |
| 25.β1E球蛋白 | β1 | — | 10 | — | — | 0.2~0.3 | 是补体第4成分,C4 |
| 26.血液结合素 | β | 57 000 | 4.8 | — | 22.6 | 0.5~1 | 结合运送血红素 |
| 27. β2糖蛋白Ⅱ | β | — | 3.7 | — | 5.7 | 0.12~0.3 | 未 明 |
| 28.纤溶酶原 | β | 143 000 | 4.3 | 5.6 | — | 0.2~0.4 | 纤维蛋白溶解作用的酶原 |
| 29.纤维蛋白原 | β | 341 000 | 7.6 | 5.8 | 2.5 | 2~4.5 | 凝血作用,急时相物质 |
| 30.β2糖蛋白Ⅰ | β | 40 000 | 2.9 | — | 18.8 | 0.15~0.3 | 未 明 |
正常人血浆蛋白质总浓度为70g/L左右。这相对恒定的浓度是体内正常合成、分解和血管内外平衡分布三种过程的综合结果。其中一个因素失常就可引起蛋白质浓度(尤其是清蛋白)的改变。
多数血浆蛋白质是由肝细胞合成和分泌的。γ球蛋白中主要是抗体,现已明确它们是由浆细胞合成和释放。各种血浆蛋白质除了浓度不同外,各自的半寿期也不同。但是血浆蛋白质的分解过程尚不清楚; 一般认为蛋白质变性后由组织或吞噬细胞经胞饮作用摄取,以后由溶酶体中蛋白酶作用而分解。肝、肾、脾、肠粘膜等皆有活跃的胞饮作用及组织蛋白酶。血浆中糖蛋白的半寿期和其糖链的完整程度有关; 当一部分糖基,尤其是分子周边的唾液酸被水解去除后,形成的去唾液酸糖蛋白就甚易被肝摄取。现认为肝细胞上有认识去唾液酸糖链的特异受体。
清蛋白 人血浆清蛋白的含量占血浆蛋白质总量的半数以上,正常数值为35~45g/L。目前制得最纯的人清蛋白的分子量为65 000,是含575个氨基酸残基的单链蛋白质。一般提纯的清蛋白常杂有可能由二硫链相连的“二聚体”,此外,亦有人含由遗传所决定的“二聚体”,因此一般认为其分子量在65 000~70 000。人清蛋白多肽链的氨基末端是天门冬氨酸,羧基末端为亮氨酸; 用旋光色散法估计链中40~50%为α右手螺旋。链中有十七个二硫键将链联系组成3~4个区,然后成为外形椭圆的分子(14.4×4.8×2.4nm3)。
清蛋白易溶于水,在pH7.4时每分子可带10个负电荷,因此,可与金属离子如Zn2+、Ca2+等结合,但清蛋白能与不同性质的代谢物结合(如游离脂肪酸,氨基酸,胆色素,药物如磺胺类及青霉素G等,固醇类激素,金属离子等),具重要运送功能的原因在于其三级结构的 “适应性”。已发现当清蛋白与不同物质结合时,或在不同pH下,均可表现微细三级结构不均一性。就是说分子中的各氨基酸残基侧链可视周围条件而变换其在分子中的地位,以易于接受不同代谢物基因。
清蛋白的形状较对称,所以它比γ球蛋白及纤维蛋白原对血液粘度的作用小。然而它的分子量较小,且在血浆中浓度较大,所以75~80%的血浆渗透压由其造成,因此,血浆清蛋白是维持血容量的主要因素,它的浓度下降可导致组织水肿。对肝病或营养不良等适应证患者可用纯化清蛋白液加以补救。
清蛋白由肝细胞合成,合成量高达肝脏合成蛋白质总量的半数。合成后经高尔基体分泌入血并与血管外的蛋白质平衡。清蛋白在血管内外分布之比为40:60,后者主要在皮肤、肌肉及肠粘膜组织中。它在血浆中的半寿期约为15天。实验指出清蛋白的合成受合成部位胶体渗透压的调节,如果胶体渗透压下降则引起合成增加。常观察到血浆球蛋白增高时血浆清蛋白水平下降,其原因是这时清蛋白分布到血管外使合成处的胶体渗透压增高,进一步抑制了清蛋白的合成。清蛋白的分解代谢一般已见前述,详情则未明; 一部分(约1/10)可经肠道分解排出。合成减少(如营养不良)、分解加强 (如甲状腺功能亢进)及由血管内流失(如烧伤) 皆能造成血浆清蛋白浓度下降。
α及β球蛋白 α及β球蛋白都是极不均一的蛋白类,各包括许多具有重要特异功能的蛋白质; 其中一些和凝血及抗凝血有关,一些则是补体系统的成分 (如β1-A球蛋白等)。此处仅例举含量较多的具有其它功能的球蛋白。它们大多在肝脏中合成; 微量的酶和激素等可来自不同的脏器。
α1抗胰蛋白酶(αAT) α1抗胰蛋白酶是血清电泳图谱中α1区的主要成分。每百毫升血清中约含200余毫克。α1AT有多种遗传变种,纯化的蛋白质仍有不均一性、不稳定,分子量约在50 000,含糖在10%以上,它的特殊功能是能抑制蛋白酶。血清中能与蛋白酶结合而发挥抑制剂作用的蛋白质至少有六种: α1AT、α2巨球蛋白,间α抗胰蛋白酶、α1抗糜蛋白酶、抗凝血酶原Ⅲ、及补体1酯酶抑制剂,但以α1AT为主要,其对胰蛋白酶抑制力达总血浆活力的90%,α1AT除对胰蛋白酶有作用外,尚对糜蛋白酶、纤维蛋白溶酶、凝血酶、弹性蛋白酶及激肽释放酶有抑制作用; 但不能抑制细菌蛋白酶。被认为具有保护作用,使组织免受逸入血液的蛋白酶的伤害。已知α1AT和慢性肺气肿有密切关系,并与遗传因素有关。
另一方面,α1AT亦为一种重要的急性应激物质;即当急、慢性感染、肿瘤、创伤、手术、妊娠以至于服用避孕药物等均能引起血清中α1AT浓度的上升。结合它对酶的抑制作用来看,α1AT对维持机体蛋白质代谢的平衡起着重要作用。
其它急性应激物质尚有α1酸性糖蛋白、α2区的铜蓝蛋白、纤维蛋白原、结合珠蛋白、补体3以及血清“粘蛋白”。除纤维蛋白原外,它们都有较高的酸性,pl在4.5以下并且都含多量糖分(10~40%)。
血清粘蛋白 “粘蛋白”是一个临床化验的项目,它不是一个均一成分。“粘蛋白”的浓度在上述应激状态下增高;因此可以反映一些疾病过程。“粘蛋白”是指血清中不能在pH4.5时加热变性沉淀,亦不能被酸性蛋白质沉淀剂沉淀的血清蛋白质。它包括多种血清酸性糖蛋白如α1酸性糖蛋白、α1抗胰蛋白酶、结合珠蛋白及其它α和β球蛋白,亦含有少量清蛋白。正常血浆中“粘蛋白”占血清总蛋白的1%,其中含糖(己糖和己糖胺)占总蛋白结合糖的10%。
α1球蛋白中具特异运送作用的蛋白质有转运皮质素、甲状腺结合球蛋白。另外还有转运视黄醇的视黄醇结合蛋白,后者在血清中又与前清蛋白(亦运送甲状腺素)结合成复合物而存在。
甲胎蛋白 甲胎蛋白在胎儿血浆中存在。孕妇血浆中及肝癌患者血浆中的甲胎蛋白比正常人明显升高; 正常血浆不超过10μg/L,其功能未明,主要作为诊断肝癌的指标。
铜蓝蛋白 是运送铜离子的酸性含糖的α2-球蛋白,具蓝色。铜蓝蛋白由两种多肽链(称α及β)构成,含铜0.34%(重量)。因此它的纯度可用对蓝色吸收与对蛋白质吸收之比(610nm/280nm光密度比) 来衡量; 纯铜蓝蛋白的比值为0.042~0.047,Cu+及Cu++皆可与之结合。铜蓝蛋白是运送铜离子的媒介,对组织中(尤其是肝)铜的含量也起调节作用。先天性铜蓝蛋白缺乏症时血清铜蓝蛋白下降,但脑及肝中的铜含量增高并因此而造成神经及肝脏症状。铜蓝蛋白尚具有氧化酶活力,参与自由基的反应,防止自由基对细胞的损伤。
α2巨球蛋白 (α2M) α2巨球蛋白是另一个血浆蛋白酶抑制剂,可以抑制胶原酶的活性。占血浆α2-球蛋白总量的1/3。α2巨球蛋白由Cohn组分III-O中提取,但分子不稳定,估计其分子量 (二聚体) 在650 000~725 000。α~M分子由二条多肽链构成,通过二硫键相联; 两个分子聚合成二聚体存在。
α2M能与多种蛋白酶结合,包括胰液中的酶、凝血酶、纤维蛋白溶酶、组织蛋白酶以至植物蛋白酶,多数形成1:1分子复合体。复合体极易由血浆中清除出去。实验指出131I标记的α2M在血浆中的半寿期为135h,但如先将α2M与纤维蛋白溶酶结合,则一小时后就有70%被清除。可以看出α2M等蛋白酶抑制剂是通过对生理或病理过程中释入血液的蛋白酶进行了处理而对机体有保护作用。此外,实验指出,α2M与蛋白酶结合后发生了相互作用,使α2M受到部分水解。α2M分子的这种改变使之表现为对蛋白酶的抑制作用。这可能是大分子蛋白酶抑制剂作用的一种方式。
孕妇、服用避孕药的妇女、糖尿病、肾病、肺气肿、烧伤等病人血浆中的α2M水平升高。
结合珠蛋白 (Hp) 血浆中结合珠蛋白约占α2球蛋白总量的1/4。用淀粉凝胶电泳研究已明确Hp有许多遗传变种。现知结合珠蛋白分子中有两种主要类型的多肽链,称α及β链; 每分子有四条链即α2β2通过二硫键交联起来。α链又有α1F、α1S及α2之分,其中α1F及α1S仅有一氨基酸之差,而α2链是α1F及α1S的融合,其长度略小于后二者之和,并多含一个半胱氨酸残基。因此结合珠蛋白共有三种遗传表型: Hp1-1,由α21β2组成;Hp2-2,由α22β2组成并可相互通过多余的半胱氨基残基交联成一系列(α22β2)n聚合体; Hp2-1则由半个Hp1-1加半个Hp2-2组成,即α1β(α2β)n,所以不同的Hp有不同的分子量。Hp1-1的一级结构和二级结构的研究指出它与免疫球蛋白G分子的相似性,提示这些分子在发生学上的同源性。Hp分子的多样性在人群遗传学的研究上及法医学应用上都有一定价值。
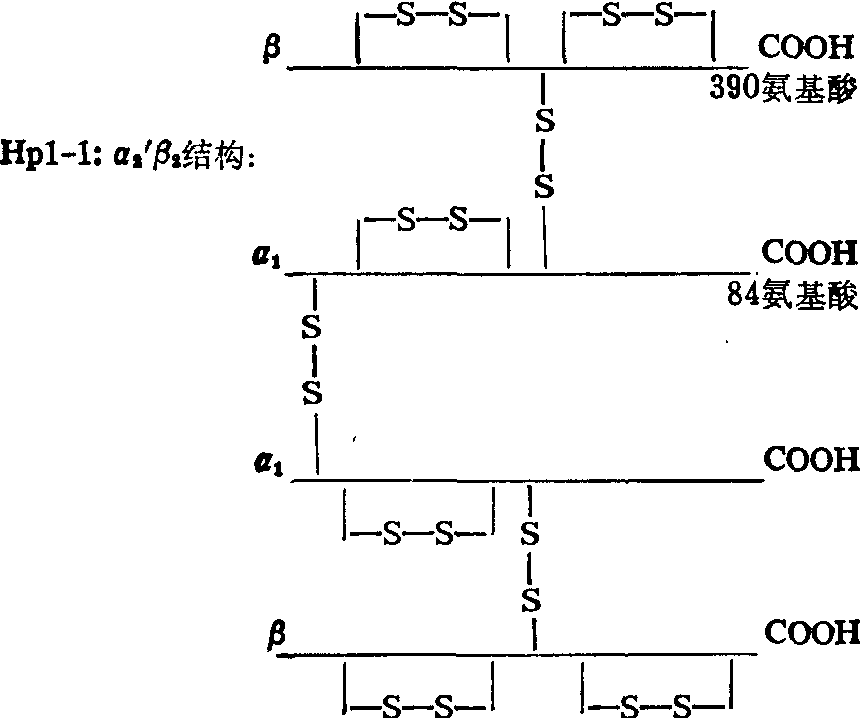
结合珠蛋白由肝脏合成。它的生理功能是运送血红蛋白(Hb)。Hp与Hb分子按1:1比例形成特异的、稳定的复合体。复合体能迅速被网状内皮系统移去,使Hb参加分解代谢,便于铁的重新利用。血浆中游离Hp的半寿期为3天而复合物的半寿期为90分钟。现在认为Hp的运送作用可防止铁由尿中排出并保护肾脏不受Hb损害。血管中发生溶血时,血浆Hp浓度下降; 当Hb释放超出Hp的负载能力时, Hb
 的亚基 (αβ)部分经肾脏重吸收,部分由尿中排出。Hp亦为一个应激蛋白质。
的亚基 (αβ)部分经肾脏重吸收,部分由尿中排出。Hp亦为一个应激蛋白质。转铁蛋白 转铁蛋白是β-球蛋白中的主要成分,其量可达总血浆蛋白的3~4%,是一个分子量约为75 000的糖蛋白。转铁蛋白是由肝脏合成的一条多肽链分子。
每分子转铁蛋白可与两原子的三价铁结合; Fe3+是铁的运送形式。正常血清中约1/3转铁蛋白是与铁结合的。含铁的转铁蛋白比无铁的转铁蛋白更易被组织细胞,尤其是网状内皮细胞所摄取。当转铁蛋白缺乏时,注入血浆的59Fe的半寿期是5min,而在正常血浆中它的半寿期是70~140min。可见转铁蛋白有运送和调节血清铁浓度的作用,从而防止铁在组织中的沉积和从尿中逸出。缺铁患者血浆中转铁蛋白水平升高。
转铁蛋白亦能与Cu2+及Zn2+结合。转铁蛋白有二十余钟遗传变种,在多数人血浆中存在的称C型,其意义未明。
血液结合素 血液结合素是另一含糖量多的β-球蛋白。它与血红素形成1:1的分子结合体,后者进入肝脏被代谢,从而保证了血红素中铁的重新利用。溶血过程加强时首先发生结合珠蛋白的消耗,继而血液结合素亦下降,因此血液结合素浓度的测定可提示溶血的程度。
β2微球蛋白 β2微球蛋白在正常血浆中含量甚微。它的分子量是10 000,因此可由尿排出;它在尿中的含量约为0.1mg/L。现认为β2微球蛋白是组织相容性抗原分子中的轻链,可能是各种组织相容性抗原的一个共同组分。镉中毒时,尿中出现此种蛋白,故常作为镉中毒的检查指标。
冷球蛋白 血清冷却时有少量蛋白质会沉淀,凝聚或结晶出来,称为冷球蛋白。它的分子量约在20万左右,现认为是一种γ球蛋白。有些类风湿性关节炎及多发性骨髓瘤病人血中此种蛋白质增加。
- 1730年是什么意思
- 1730年~1732年是什么意思
- 1731年是什么意思
- 1732年是什么意思
- 1732年售帽法是什么意思
- 1733年是什么意思
- 1733年~1735年是什么意思
- 1734年是什么意思
- 1735年是什么意思
- 1736年是什么意思
- 1736年~1738年是什么意思
- 1736年~1795年是什么意思
- 1737年是什么意思
- 17382是什么意思
- 1738年是什么意思
- 1739年是什么意思
- 1739年~1741年是什么意思
- 173年是什么意思
- 1740年是什么意思
- 1741年是什么意思
- 1742年是什么意思
- 1742年~1744年是什么意思
- 1743年是什么意思
- 1744年是什么意思
- 1745年是什么意思
- 1745年~1747年是什么意思
- 1746年是什么意思
- 1747年是什么意思
- 1748年是什么意思
- 1748年~1750年是什么意思
- 1749年是什么意思
- 174年是什么意思
- 1750年是什么意思
- 1750年制铁条例是什么意思
- 1751年是什么意思
- 1751年~1753年是什么意思
- 1752年是什么意思
- 1753年是什么意思
- 1754年是什么意思
- 1754年~1756年是什么意思
- 1755年是什么意思
- 1756年是什么意思
- 1756年准则是什么意思
- 1756年战时准则是什么意思
- 1757年是什么意思
- 1757年~1759年是什么意思
- 1758年是什么意思
- 1759年是什么意思
- 1759年~1766年是什么意思
- 175—1柴油机是什么意思
- 175年是什么意思
- 175米超深井是什么意思
- 1760年是什么意思
- 1760年~1762年是什么意思
- 1761年是什么意思
- 1762年是什么意思
- 1763年是什么意思
- 1763年公告是什么意思
- 1763年巴黎和约是什么意思
- 1763年~1765年是什么意思