硼族元素
硼族元素pengzu yuansu
周期系第Ⅲ主族元素,包括硼、铝、镓、铟、铊5种元素。它们的一般性质见表1。
表1 硼族元素的一般性质
| 元 素 | 硼B | 铝Al | 镓Ga | 铟In | 铊Tl |
| 原子序数 | 5 | 13 | 31 | 49 | 81 |
| 价层电子构型 | 2s22p1 | 3s23p1 | 4s24p1 | 5s25p1 | 6s26p1 |
| 原子半径/pm 沸点/℃ 熔点/℃ 电负性 电离势/kJ·mol-1 电子亲合热/kJ·mol-1 | 82 2550 2300 2.0 801 23 | 125 2467 660 1.5 578 44 | 125 2403 30 1.6 579 36 | 144 2000 156 1.7 558 34 | 155 1457 303 1.8 589 50 |
 M3+/M/V M3+/M/V | -1.66 | -0.53 | -0.34 | -0.34(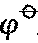 n+/n) n+/n) | |
| 氧化态 配位数 晶体结构 | +3 3, 4 原子晶体 | +3 3, 4, 6 金属晶体 | (+1), +3 3, 6 金属晶体 | +1, +3 3, 6 金属晶体 | +1, (+3) 3, 6 金属晶体 |
硼是非金属性占优势的元素,其他元素为金属,其金属性随原子序数的增加而增强。硼的氧化物为酸性,铝和镓的氧化物为两性,铟和铊的氧化物则是碱性。硼的化合物完全是共价型的,而其他元素均可形成M3+。硼族元素的原子最外层有3个电子,其构型为ns2np1,为缺电子原子。它们所形成的共价化合物,有时为缺电子化合物,并由于有很强的接受电子对的能力,易形成聚合型分子如Al2Cl6,和配位化合物如HBF4。硼族元素的化学性质见表2。
表2 硼族元素的化学性质 (M为金属元素)
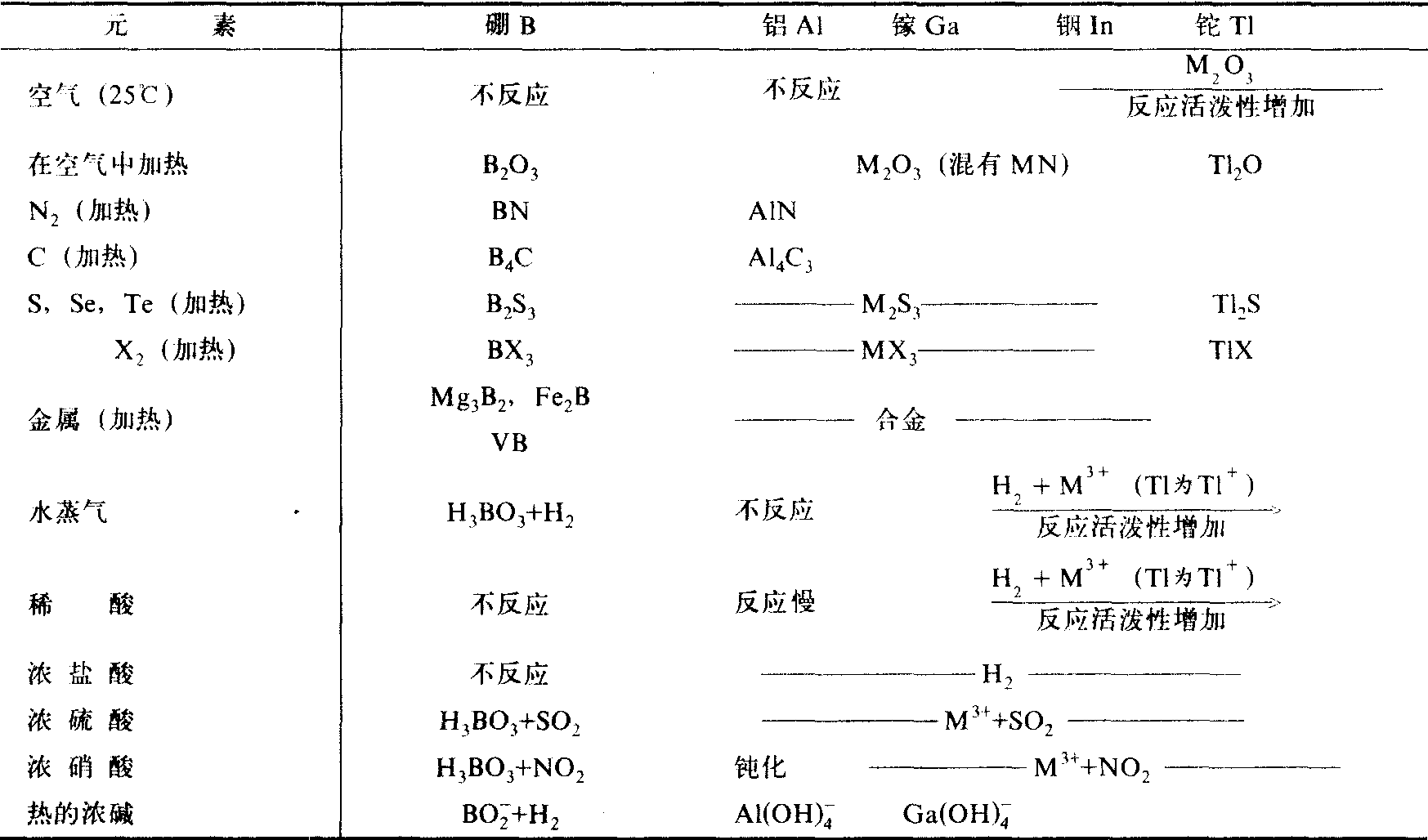
硼具有 一般非金属元素反应的性能,它有较大的电负性,能与金属形成硼化物。铝和氧化合时放出大量的热,还能将许多金属氧化物还原为单质,可用于制备一些难熔金属单质 (Cr,Mn,V等),称为铝热法。例如:
8Al+3Fe3O4=4Al2O3+9Fe
温度可高达3000 ℃。
硼族元素用途广泛。硼是核反应堆中良好的中子吸收剂。铝广泛地用做结构材料; 高纯度的镓、铟、铊可用于生产新型半导体材料。
☚ 铬酸钡 硼 ☛
- 易珍瑞是什么意思
- 易理寻源是什么意思
- 易理汇参是什么意思
- 易理象数合解是什么意思
- 易理阐真是什么意思
- 易琼是什么意思
- 易瑜是什么意思
- 易瑾是什么意思
- 易璇玑是什么意思
- 易生是什么意思
- 易生行谱例言是什么意思
- 易用是什么意思
- 易田制是什么意思
- 易画轩是什么意思
- 易略是什么意思
- 易畴是什么意思
- 易疏是什么意思
- 易疑是什么意思
- 易疑初筮告蒙约是什么意思
- 易白沙是什么意思
- 易皆斋是什么意思
- 易盛富是什么意思
- 易直是什么意思
- 易直子谅之心生则乐。是什么意思
- 易眉伽是什么意思
- 易睐娘是什么意思
- 易知由单是什么意思
- 易研是什么意思
- 易确是什么意思
- 易碎品是什么意思
- 易碎性是什么意思
- 易碎性货物是什么意思
- 易碎物品是什么意思
- 易碎物品包裹是什么意思
- 易碎货物是什么意思
- 易碎饼干是什么意思
- 易礼容是什么意思
- 易祓是什么意思
- 易祓妻是什么意思
- 易祓妻《一剪梅》是什么意思
- 易祓妻萧氏是什么意思
- 易祖师是什么意思
- 易祯贵是什么意思
- 易禮容是什么意思
- 易秉乾是什么意思
- 易秋潭是什么意思
- 易科服劳役是什么意思
- 易科罚金是什么意思
- 易科训诫是什么意思
- 易租车是什么意思
- 易稽览图是什么意思
- 易稽览图中孚传是什么意思
- 易穷则变是什么意思
- 易窗道人是什么意思
- 易窥是什么意思
- 易立新是什么意思
- 易章句是什么意思
- 易笏山行状是什么意思
- 易笞条例是什么意思
- 易笺是什么意思