溶液稀释后的pH值计算
溶液稀释后的pH值计算rong ye xi shi hou de pH-zhi jishuan
溶液被溶剂稀释后体积增大,而溶质的量没有变化,则浓度相应下降。根据稀释前、后溶质的量不变的原则,可得到稀释规则:
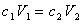
式中c1,c2分别表示浓溶液和稀溶液的浓度(mol/L);V1,V2分别表示浓溶液和稀溶液的体积(L)。对强电解质溶液求出稀溶液的浓度,便知其H+浓度,即可计算pH值。弱电解质溶液稀释后电离度增加,必须用电离常数与浓度、电离度的关系计算H+浓度,然后求其pH值。
例 1 取pH1=3盐酸溶液 1mL,加水稀释至100mL,求稀盐酸的pH2值。
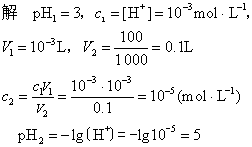
答 稀盐酸的pH为5。
例2 已知醋酸的电离常数Ka =1.8×10-5 ,今取c=0.1 mol·L-1醋酸溶液1mL,加水稀释至100mL,求溶液的pH变化。
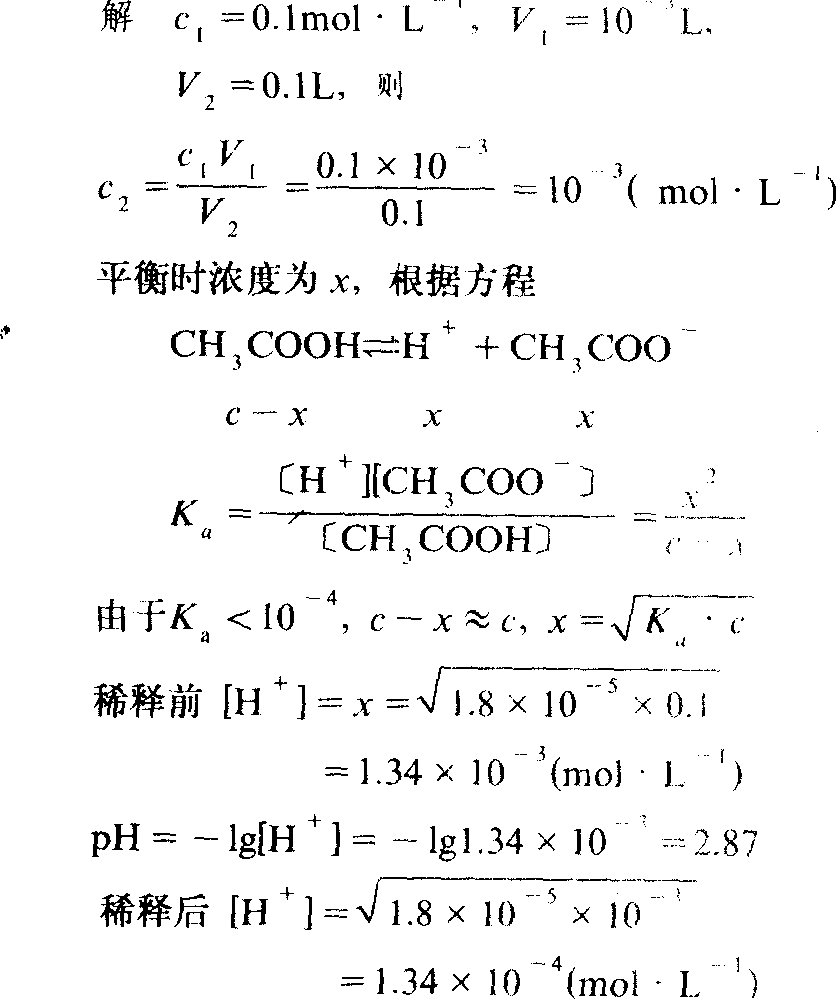
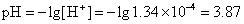
答 溶液的pH值由2.87变到3.87。
以上的pH值计算中,因水电离出的H+比酸电离出的H+少得多,均可忽略不计。当酸的浓度小于10-7mol·L-1,10-8mol·L-1或更小时,溶液中的H+主要来自水的电离,而酸电离出的H+可忽略不计。例如,碱溶液中的H+就是来自水的电离。下题将说明这点。
例3 将PH1=6的盐酸溶液1mL,加水稀释至100mL,求盐酸的浓度和溶液的pH2值。
解 盐酸为强电解质,pH=6,
〔H+〕=10-6mol·L-1
稀释后盐酸的浓度:
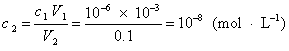
溶液的H+来自水的电离和盐酸的电离,可粗略地认为:
〔H+〕=10-7+10-8=1.1×10-7(mol·L-1)
pH=-1g〔H+〕=-1g1.1×10-7=6.96=7
答 稀盐酸的浓度为10-8 mol·L-1,溶液的pH
为7。
例4 将pH1=13的NaOH溶液1mL加水稀释至100mL,求稀释后NaOH溶液的pH2值。
解 NaOH为强电解质在水中100%电离,由pH1=13,得
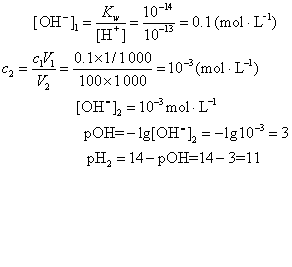
答 稀NaOH溶液的pH为11。
☚ pH值的计算 不同浓度酸或碱混合后的pH值计算 ☛
- 干预货币是什么意思
- 干预货币是什么意思
- 干预货币是什么意思
- 干预资产是什么意思
- 干颓汤是什么意思
- 干颓汤是什么意思
- 干颗粒法压片是什么意思
- 干颤是什么意思
- 干饧糟是什么意思
- 干饧糟是什么意思
- 干饼残油率是什么意思
- 干饼(粕)残油率是什么意思
- 干馏松油是什么意思
- 干馏松节油是什么意思
- 干馏法是什么意思
- 干香柏是什么意思
- 干骺端是什么意思
- 干髓术是什么意思
- 干鲜果品是什么意思
- 干鲜果品经营是什么意思
- 干鸽舞是什么意思
- 干鹊知来是什么意思
- 干黄靴是什么意思
- 干龙船是什么意思
- 平是什么意思
- 平是什么意思
- 平是什么意思
- 平是什么意思
- 平是什么意思
- 平是什么意思
- 平是什么意思
- 平是什么意思
- 平是什么意思
- 平是什么意思
- 平是什么意思
- 平、议价粮油指标划转是什么意思
- 平、议价粮油统一储存分帐核算法是什么意思
- 平、议价粮油费用分摊法是什么意思
- 平东郭氏正骨法是什么意思
- 平中饮是什么意思
- 平临云鸟入窗秋,北压西川四十州是什么意思
- 平临云鸟八窗秋,壮压西川四十州。诸将莫贪羌族马,最高层处见边头。是什么意思
- 平乐(—lè)是什么意思
- 平乐县志是什么意思
- 平乐府志是什么意思
- 平乐馆是什么意思
- 平乡是什么意思
- 平乡县志是什么意思
- 平井泰太郎是什么意思
- 平亚丽是什么意思
- 平交是什么意思
- 平人气象论是什么意思
- 平仄是什么意思
- 平仄是什么意思
- 平仄虚实是什么意思
- 平仄转夹叶兼抛线是什么意思
- 平仄转韵格是什么意思
- 平仄韵不得通融是什么意思
- 平仄韵互改是什么意思
- 平仄韵交错格是什么意思