气体分子的平均自由程
气体分子的平均自由程qiti fenzi de pingjun ziyoucheng
平衡态时,分子在连续两次碰撞之间所通过自由路程的统计平均值,以λ表示,这是描述分子热运动情况的一个微观量,分子间相互碰撞得越频繁,平均自由程就越小。
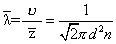
ῡ是分子热运动的平均速率,
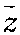 是平均碰撞频率,d是分子的平均有效直径,n是单位体积内的分子个数。上式表明气体一定时(即d-定)其数密度越小,则平均自由程越大。 也可以直接表示出
是平均碰撞频率,d是分子的平均有效直径,n是单位体积内的分子个数。上式表明气体一定时(即d-定)其数密度越小,则平均自由程越大。 也可以直接表示出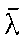 与T、p的关系
与T、p的关系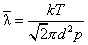
即
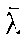 与温度T成正比,与压强p成反比。下表给出了几种气体平均自由程的值。
与温度T成正比,与压强p成反比。下表给出了几种气体平均自由程的值。在15℃,1.013×105帕情况下,几种气体的平均自由程
| 气体 | 氢 | 氮 | 氧 | 二氧化碳 |
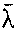 /m /m | 11.8×10-8 | 6.28×10-8 | 6.79×10-8 | 4.19×10-8 |
在0℃,不同压强下,空气的平均自由程
| 压强 (Pa) | 1.013× 105 | 133.3 | 1.333 | 1.333× 10-2 | 1.333× 10-4 |
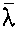 /m /m | 7×10-8 | 5×10-8 | 5×10-3 | 5×10-1 | 50 |
在研究气体内输运过程的初级理论时,常常用到这个物理量,例如粘度系数,热传导系数、扩散系数分别为:
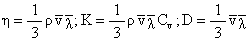
ρ是气体的密度,Cv是定体摩尔热容。上述公式表明宏观量是微观量的统计平均值。平均自由程
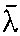 越大,分子在运动过程中与其他分子相碰撞的次数就少,即输运过程中受到的阻碍就小,表现为η、K、D的数值大,则表示在由非平衡态向平衡态过渡的输运过程进行得顺利。
越大,分子在运动过程中与其他分子相碰撞的次数就少,即输运过程中受到的阻碍就小,表现为η、K、D的数值大,则表示在由非平衡态向平衡态过渡的输运过程进行得顺利。☚ 分子平均有效直径 平均碰撞频率 ☛
- 现代造船厂是什么意思
- 现代逻辑科学导引是什么意思
- 现代邮电使用指南是什么意思
- 现代部门是什么意思
- 现代采购是什么意思
- 现代重大科技成果是什么意思
- 现代金融信托实用手册是什么意思
- 现代金融大辞典是什么意思
- 现代金融市场知识手册是什么意思
- 现代金融词典是什么意思
- 现代金融辞典是什么意思
- 现代针灸师手册是什么意思
- 现代铁塔之祖是什么意思
- 现代银行与企业工作手册是什么意思
- 现代银行会计实用手册是什么意思
- 现代银行管理是什么意思
- 现代长篇小说是什么意思
- 现代阿姆哈拉语文学之父是什么意思
- 现代陈三五娘是什么意思
- 现代陶瓷工艺是什么意思
- 现代陶瓷色釉料与装饰技术手册是什么意思
- 现代集团是什么意思
- 现代雕塑是什么意思
- 现代雕塑之父是什么意思
- 现代青年是什么意思
- 现代青年交际大全是什么意思
- 现代青年杰作文库是什么意思
- 现代青年社交手册是什么意思
- 现代非洲名人录是什么意思
- 现代革命根据地教育 (湘鄂西)是什么意思
- 现代音是什么意思
- 现代音乐是什么意思
- 现代音乐之父是什么意思
- 现代音乐大师协会是什么意思
- 现代音韵学派是什么意思
- 现代音韵学的产生是什么意思
- 现代韵律体操是什么意思
- 现代顺势医学是什么意思
- 现代领导哲学的建立是什么意思
- 现代领导学是什么意思
- 现代领导手册是什么意思
- 现代领导百科全书是什么意思
- 现代领导百科全书︱《现代领导百科全书》编委会是什么意思
- 现代领导百科全书︱前言是什么意思
- 现代领导百科全书︱后记1是什么意思
- 现代领导百科全书︱后记2是什么意思
- 现代领导百科全书︱序是什么意思
- 现代领导知识大全是什么意思
- 现代领导知识要览是什么意思
- 现代领导者是什么意思
- 现代领导者要览是什么意思
- 现代风是什么意思
- 现代风俗是什么意思
- 现代飞机是什么意思
- 现代飞机200种是什么意思
- 现代飞机解剖之王是什么意思
- 现代飞机问世是什么意思
- 现代食品发酵技术是什么意思
- 现代食品微生物学是什么意思
- 现代饭店管理服务手册是什么意思