播散性血管内凝血
简称“DIC”。又称“去纤维综合征”。是一组继发性出血综合征。多见于感染性疾病(败血症或重症毒血症)和恶性肿瘤等。主要表现为出血,低血压或休克,血小板减少,血浆鱼精蛋白付凝试验阳性,凝血酶原时间延长。治疗应去除病因,肝素抗凝,潘生丁、阿斯匹林药物等治疗。预后极差。
播散性血管内凝血
播散性血管内凝血(简称DIC)是发生于某些疾病过程中的一种出血综合征,主要由于凝血机制被激活,凝血过程加速,于毛细血管、小动静脉内广泛形成微血栓。由于微循环被阻断,血小板及多种凝血因子被消耗,以及继发性纤维蛋白溶解亢进,临床上可出现休克、出血及组织器官功能障碍等表现。
病因及发病原理 多种疾病及理化因素均可作为诱因而致病,儿科以急性感染(包括各种细菌及病毒)较为多见。某些新生儿疾病如新生儿呼吸窘迫综合征、新生儿硬肿症、新生儿溶血症及新生儿宫内病毒感染等也较易诱发DIC。其他如多种血液病、肿瘤、肝病、肾脏病、青紫型先天性心脏病、抗原抗体反应性疾病以及严重组织损伤等均可诱发致病。
DIC的发病机理主要包括两个基本病理过程。
❶凝血机制被激活: 因血管内皮损伤,使胶原组织暴露,而激活第Ⅻ因子(即激活内在凝血系统); 或因组织损伤后组织凝血活酶进入血流促动外在凝血系统;或因血小板或(和)红细胞大量破坏释放出血小板第Ⅲ因子或(和)红细胞素,激活内在或外在凝血系统; 均可使血流中凝血酶生成过多,加速凝血过程,使血液处于高凝状态,以致小血管内广泛形成血栓。随凝血过程的进行,大量凝血因子及血小板被消耗,血液从高凝状态又转为低凝状态,从而发生出血倾向。单核吞噬细胞系统 (也称网状内皮系统)有清除血循环内凝血酶,凝血活酶、纤维蛋白及其裂解产物等作用,当其功能受损时可加速凝血过程,促使DIC的发生。低血压,血流淤滞,血液浓缩、缺氧、酸中毒等均为促使发病的因素。
❷纤维蛋白溶解系统被激活: 在凝血酶、被激活的Ⅻ因子、组织器官受纤维蛋白沉积损伤后释放出来的纤维蛋白溶解酶原激活物质、以及手术创伤、失血、缺氧、低血压、酸中毒等因素的作用下,纤维蛋白溶解酶原被激活转变成纤溶酶,促使纤维蛋白溶解; 加之其裂解产物有抗凝作用,因而发生出血倾向。以上两种病理过程的进展程度与病程早晚有关,DIC早期以凝血过程加速(微血栓形成)为主;晚期则以纤维蛋白溶解亢进为主。
临床表现 (1) 出血: 最常见,轻者仅见皮肤出血点,重者可自发性多部位出血。除皮肤外,胃肠道、牙龈、鼻等部位出血也较常见。有伤口时常出血不止。处于高凝状态的病例可无出血。早期因重要脏器栓塞而迅速死亡的病例可始终无出血症状。
(2) 栓塞症状: 由于微循环内广泛血栓形成,血流受阻,组织器官缺血、缺氧、代谢紊乱,因而出现功能障碍甚至组织坏死。临床表现因受累器官及其受累程度不同而各异,常见者为皮肤大片瘀斑,消化道出血,也可发生血尿,少尿,肾功能衰竭,肾上腺皮质功能低下,咯血,呼吸衰竭,惊厥,昏迷,肝、心功能障碍、四肢末端坏死等。
(3) 休克: 由于微循环受阻,回心血量及心排出量减少,加之于被激活的Ⅻ因子的作用下产生舒血管素引起小动脉扩张,导致血压下降,甚至发生休克。严重休克多见于感染性疾病引起的DIC。此外,休克时也可继发DIC,故DIC与休克互为因果,呈恶性循环。
(4) 溶血: 因红细胞于通过纤维蛋白网眼时受损伤,以及受沉积于细胞表面的纤维蛋白丝的损伤而大量破坏所致。临床可出现黄疸、腰背酸痛,血红蛋白尿等症状。周围血涂片可见红细胞有明显形态改变,如呈芒刺状、盔形、三角形及碎片等。
诊断 临床上出现上述症状,又存在可能引起DIC的诱因(或基础疾病)时,应高度警惕DIC的可能,再结合下列实验室检查明确诊断。
(1) 反映消耗性凝血障碍的化验:
❶血小板降至10万/μl以下或进行性下降。某些血液病、肝病、严重感染时血小板计数本来就低,故动态观察更有意义。
❷凝血酶原时间延长(较正常12秒延长3秒以上)。
❸血浆纤维蛋白原低于160mg/dl或进行性下降。
(2) 反映纤维蛋白形成及纤维蛋白溶解亢进的试验:
❶鱼精蛋白副凝试验 (plasma protamin paracoagula-tion test,简称3P试验)或乙醇胶试验(DIC晚期多为阴性)、葡萄球菌凝集试验、Fi试验等阳性,或血浆纤维蛋白降解产物(FDP)增高(超过20μg/ml)。
❷ 优球蛋白溶解时间短于120分钟,或血浆素原含量降低。
❸凝血酶凝固时间延长5秒以上。
❹血片中可见三角形、盔形、葫芦形、芒刺状等畸形红细胞(达2%以上)。
一般认为上述(1)试验中有三项异常即可诊断。如果仅有二项异常,则需再加(2)试验中有一项异常才可诊断。
治疗 宜早期诊断,及时采取综合措施。除积极治疗原发病、加强护理及一般治疗外,早期以应用抗凝疗法为主,晚期则以抗纤维蛋白溶解药物为主。在消耗性低凝期继发纤维蛋白溶解占优势时,于应用肝素抗凝的基础上可加用抗纤维蛋白溶解药物。具体治疗措施如下:
(1) 治疗原发病:去除病因,如选用有效抗生素控制感染等。
(2) 改善微循环: 用低分子右旋糖酐10ml/kg静脉滴注,以后5ml/kg每6小时一次,全日总量约30ml/kg。于补充血容量的同时应用血管活性药物以解除血管痉挛,增加微循环灌注量,常用者如莨菪碱类药物(654-2,阿托品,东莨菪碱)、多巴胺等。并应及时纠正酸中毒,改善缺氧状态。
(3) 抗凝血,阻止微血栓形成:
❶抗血小板凝集药物,如潘生丁(10mg/kg),乙酰水杨酸等。
❷肝素每次0.5~1mg/kg加于生理盐水或葡萄糖液40~60ml静脉滴注(病情急重者首次量可溶于20ml液体内静脉注入),每4~6小时一次,使凝血时间(试管法)控制在20~30分钟。如原发病已控制,DIC症状消失,化验恢复正常即逐渐减量停药。一般用药3~7天(有些病例如暴发性流行性脑脊髓膜炎应用数次即可)。如用药后出血严重,考虑为肝素过量时,可用鱼精蛋白中和,按最后一次肝素用量计算,1mg鱼精蛋白中和1mg肝素。
❸对早期出现重要脏器栓塞症状的病人可使用血栓溶解药物,如链激酶、尿激酶等。
(4) 补充凝血物质: 于消耗性低凝期出血严重者,可于应用肝素、潘生丁的同时输予富于血小板的新鲜血或血浆。
(5) 用抗纤维蛋白溶解剂以控制出血: 仅于DIC后期当继发性纤维蛋白溶解症非常显著亢进且成为出血的主要原因时,于足量肝素治疗下方可选用。常用6-氨基己酸、对羧基苄胺等。
播散性血管内凝血
播散性血管内凝血(DIC)是在某些致病因子作用下凝血系统或血小板被激活而引起的一个病理过程。此时,微循环中有血小板团块或纤维蛋白微血栓形成,一系列血浆凝血因子被消耗,血小板减少,并有继发性纤维蛋白溶解(纤溶)过程的启动。过去根据此过程的某个侧面,曾有各种不同的名称,如去纤维蛋白综合征、获得性低纤维蛋白原血症、消耗性凝血病、弥散性血管内血栓形成等。目前认为,DIC是很多疾病发病过程中的一个中间机制。
一般将DIC分成急性、亚急性和慢性三种。有人还认为有亚临床型。后者是指临床表现不明显,只有用比较精细的检查方法(凝血和纤溶)或尸检时才能发现的类型。此外,从机体的代偿角度看,DIC又可分为代偿型、失代偿型和过度代偿型。代偿型常见于轻型DIC,其特点是循环血液内血小板、纤维蛋白原及凝血因子变化不大,用一般方法难以测出纤维蛋白(原)降解产物(FDP);失代偿型的特点是血小板、纤维蛋白原及凝血因子明显减少,FDP增多,常见于急性或重型DIC;过度代偿型的特点是血小板和(或)纤维蛋白原增多,常见于DIC早期或恢复期。
1. 病因及发病机制:DIC在临床各科都可遇到,有多种起因,可通过不同的途径激活体内的内源性或(和)外源性凝血系统而引起。
(1) 血管内皮细胞的损伤: 休克时持续低血压产生的缺氧,败血症中细菌内毒素的作用,以及细菌、病毒、螺旋体等,都可使血管内皮细胞发生损伤,使其下面的胶原暴露。由于胶原纤维中谷氨酸和门冬氨酸残基较多,是带负电荷的酸性蛋白质,能与XII因子分子中的精氨酸残基发生反应,使其空间构型发生改变,XII因子的肽链被打开,某些嫌水基团暴露,这些基团可能是XII因子的活性部分,从而使XII因子被激活,生成XIIa。胶原激活凝血因子XII的这一过程进行得较为缓慢,生成的XIIa也较少,但因XII的段片(XIIf)可把血浆激肽释放酶原激活成激肽释放酶,后者又能反过来使XII因子进一步活化,从而使内源性凝血系统的反应加速。激肽释放酶还可通过纤溶系统和补体系统进一步促进DIC发展。
血管内皮细胞的损伤启动凝血过程主要是通过激活内源性凝血系统进行的。
(2) 组织严重破坏使大量组织因子进入血液: 外科大手术、严重的创伤、产科意外(如胎盘早期剥离、宫内死胎等)、恶性肿瘤或实质性脏器广泛坏死等,可通过外源性凝血系统引起凝血。组织损伤释放大量组织因子 (凝血因子Ⅲ)进入血液。组织因子是一种脂蛋白复合物,含有大量磷脂。组织因子进入血浆后,血浆中的钙离子将因子Ⅶ连接于组织因子的磷脂上形成复合物,后者可使凝血因子X活化(Xa)。Xa与Ca++、因子V和血小板磷脂相互作用而形成凝血酶原激活物,然后通过与内源性凝血系统一样的途径,完成凝血的化学反应。但在羊水栓塞时,羊水可不经过VII因子而直接激活因子X。
凝血因子Ⅲ主要存在于细胞的内质网中,在脑、肺、胎盘中含量特别丰富。另外,肝脏、白细胞、大血管(主动脉、腔静脉)内膜、小血管及浆膜的内皮细胞等均含有凝血因子Ⅲ,因此在这些组织细胞发生坏死时,特别容易激活外源性凝血系统。
(3) 血小板的凝血活性作用: 内毒素、免疫复合物、颗粒物质、凝血酶等都可直接损伤血小板,促进血小板聚集。微血管内皮细胞的损伤,胶原纤维的暴露是引起局部血小板粘附、释放凝血因子和聚集反应的主要原因。血小板与胶原容易发生粘附,因为构成胶原的肽链中,存在一个具有活性的9肽,是胶原粘附血小板的一个活性部位。此外,血小板表面的糖蛋白I (GPI)是血小板连接血浆中因子VIII和von Willebrand因子 (VIIIv WF)的连接点。VIIIv WF的一端粘附于内皮下组织,起搭桥作用。近年来还发现,纤维蛋白连接素也可起同样作用。血小板的粘附作用,除可直接形成血小板团块堵塞微血管外,还可进一步激活血小板的凝血活性。
血小板在凝血过程中所发挥的作用,除因本身具有促凝作用外,主要与含有多种血小板凝血因子 (如PF2、PF3、PF4等)有关。这些因子可作用于凝血的不同环节,加速凝血过程。PF2可促进纤维蛋白原转变为纤维蛋白。PF3是血小板膜上的磷脂,作为表面催化剂,可将凝血因子IX、VIII、X、V、凝血酶原和Ca++浓集于表面,加速凝血反应。PF4有对抗肝素的作用,有利于凝血酶的生成和活性的发挥。血小板的上述凝血活性在DIC时有不同程度的增强,这是由于血小板在粘附过程中发生功能改变所致。
但是,在不同病因所引起的DIC中,血小板所发挥的作用并不一致。它可起原发的作用,如血栓性血小板减少性紫癜的发病之始,即可由免疫反应等原因使血小板发生聚集,并释放促凝物质使血液发生凝固而形成微血栓。但在一般DIC发病中则多起继发的作用。在外源性凝血系统被激活所致的DIC中,血小板不起主要作用。在内毒素引起的DIC中,血小板对白细胞的促凝机制还有促进作用。人体白细胞与内毒素同孵后所产生的促凝活性可因加入血小板而增强。这可能是血小板膜上的脂蛋白、白细胞及某些凝血因子相互作用造成的。
(4) 免疫复合物及补体的促凝作用: 抗原抗体反应可以引起DIC,这是免疫复合物激活XII或损伤血细胞,引起红细胞释放凝血磷脂和血小板释放促凝物质(如血小板因子3)所致。在革兰阴性细菌败血症中,细菌内毒素能激活补体系统。实验证明,如事先以蛇毒耗竭动物的补体,而后将内毒素注入去补体的动物(实验组),同时以内毒素注入未去补体的动物(对照组),结果对照组动物血压显著下降,血小板、纤维蛋白原、因子V、VII等都明显减少;实验组动物则变化轻微,存活率也显著提高。由此可见,补体系统的激活在内毒素引起的DIC中起一定作用。补体激活凝血的机制比较复杂,C3b能激活激肽释放酶原,通过激肽释放酶的形成又可激活凝血及纤溶系统,C5~9还具有纤溶活化素样作用。此外,补体系统的激活还可促使血小板聚集和释放。
(5) 其他促凝物质进入血液: 羊水等异物颗粒可通过表面接触使因子XII活化,从而激活内源性凝血系统。红细胞大量破坏时(如急性溶血性贫血、血型不合的输血),有促凝作用的磷脂(红细胞素)和使血小板聚集的二磷酸腺苷等的释放,因而可引起DIC。正常粒细胞胞质中也含有促凝物质。在内毒素或败血症所引起的DIC中,大量粒细胞在肺血管中停滞,并释放促凝物质,这些物质进入体循环,可进一步加速凝血过程。此外,急性胰腺炎时,大量胰蛋白酶进入血液能促使凝血酶原变成凝血酶;毒蛇咬伤时,某些蛇毒能使纤维蛋白原变为纤维蛋白。但是,上述原因引起DIC还与机体的功能状态和促凝物质的多少有关。下列因素可影响DIC的发生和发展。
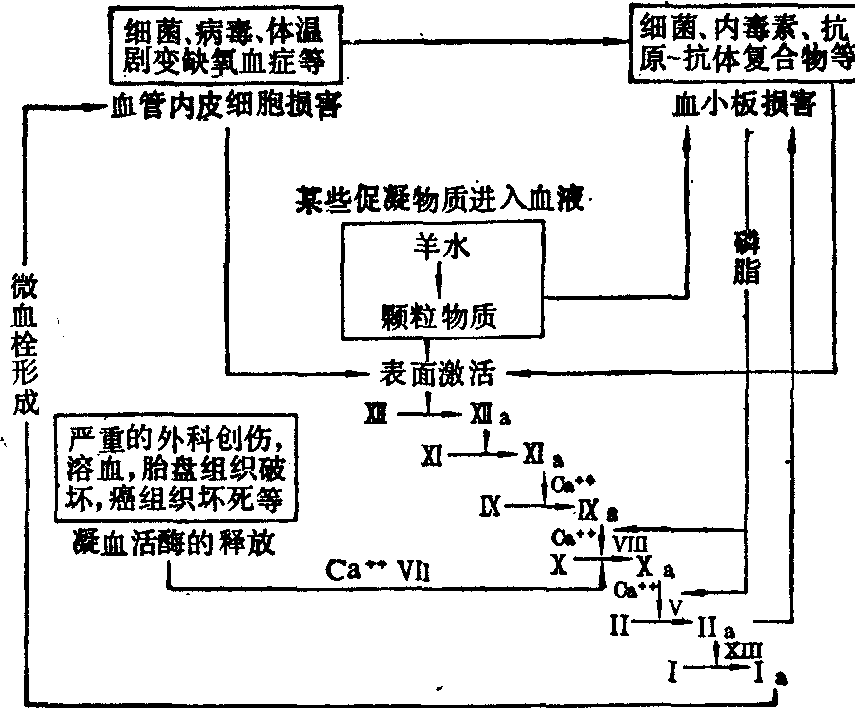
图1 DIC的发生机制
(6) 网状内皮系统功能受损: 网状内皮系统具有清除循环血液中的凝血酶、其他促凝物质、纤溶酶、纤维蛋白、FDP以及细菌、内毒素等的作用。因此,网状内皮系统的严重功能障碍会促进DIC的形成。例如在严重的革兰阴性细菌内毒素休克中,网状内皮系统可因吞噬大量坏死组织、细菌或内毒素而功能处于“封闭”状态,这时机体如再次与内毒素接触就易于发生DIC。全身性Shwar-tzman反应(GSR)就是如此。给动物在24小时内连续二次静脉注射小剂量内毒素,动物在接受第二次注射后发生休克、出血倾向,甚至因急性肾功能衰竭而死亡。死后解剖发现各重要脏器中皆有纤维蛋白微血栓,而且由此产生相应组织的缺血坏死,其中尤以肾、肺、肝等最为明显。目前一般认为GSR的发生主要是由于第一次内毒素注射封闭了网状内皮系统,因此第二次注射时,网状内皮系统无法使内毒素灭能。内毒素具有激活因子Ⅻ、促使血小板聚集和收缩血管等作用。肝硬变或长期大量服用肾上腺皮质激素,都可使网状内皮系统功能降低。在此情况下,体内只要产生少量促凝物质即可引起DIC。
(7) 肝功能严重障碍: 正常肝细胞能灭活某些已被激活的血浆凝血因子,合成某些具有抗凝或促纤溶作用的物质,所以在急性肝坏死、严重肝硬变等病人中,肝脏的上述功能严重障碍,凝血作用加强。
(8) 血液的高凝状态: 妊娠期妇女的血小板及多种血浆凝血因子(Ⅰ、Ⅱ、Ⅶ、Ⅷ、Ⅸ、Ⅹ等)均增多,而抗凝及纤溶活性(如抗凝血酶Ⅲ、纤溶酶原活化素及尿中尿激酶等)均降低,来自胎盘的纤溶抑制物却增多。妊娠妇女从怀孕4个月以后,血液开始渐趋高凝状态,到妊娠末期最为明显。因此,产科意外中DIC的发生率较高。此外,酸化的血液凝固性增高。因此在严重酸中毒的患者,血液常处于高凝状态,容易发生DIC。
(9) 促凝物质进入血液的量,速度和途径:促凝物质进入血液少而慢时,如机体代偿功能(如吞噬功能等)健全,可不发生或仅表现为症状不明显的慢性型DIC;促凝物质入血过多过快,超过机体代偿能力时,则可引起重型DIC发作。此外,DIC的定位与促凝物质入血的途径有重要关系。动物实验证明,静脉内注入凝血酶所引起的DIC,病变以肺为主;动脉内注入则以肾为主。
此外,纤溶系统的过度抑制,血流的缓慢、淤滞,血粘度增高等因素皆会促进DIC形成。DIC的发生可能还与病人当时的微血管功能状态有关。
2. 临床表现及其发生机制:
(1) 凝血功能障碍——出血:DIC时,体内凝血功能障碍总的发展规律是从高凝状态到低凝状态。具体可以分为高凝血期、消耗性低凝血期及继发性纤溶期。高凝血期是DIC的早期,此时,因促凝物质入血或因凝血因子大量被激活,出现高凝状态。在微血管中广泛形成血小板和(或)纤维蛋白微血栓。但是在DIC的全过程中,出血表现比高凝更为突出。引起出血的原因常与以下一个或多个因素有关。
❶凝血物质的消耗:在DIC发展过程中各种凝血因子及血小板的大量消耗,体内凝血因子特别是纤维蛋白原、凝血酶原、因子Ⅴ、Ⅷ、Ⅹ、ⅩⅢ和血小板普遍减少。因此曾有人将DIC称为 “消耗性凝血病”。
❷纤溶系统的激活:DIC中的纤溶系统的激活是继发的。主要由于Ⅻf可使激肽释放酶原转变成激肽释放酶,后者使纤溶酶原变为纤溶酶。一些富含纤溶酶原激活物的脏器,如因血管内凝血而发生变性坏死,则激活物大量释放入血,激活纤溶系统。因此,血管内皮细胞受损、缺氧、应激反应等都可激活纤溶系统,导致纤溶酶增多。纤溶酶能水解凝血因子Ⅴ、Ⅷ和凝血酶原等,使这些凝血因子进一步减少,引起凝血障碍和出血。
❸纤维蛋白(原)降解产物的形成: 凝血过程的激活及继发性纤溶过程的启动使血中纤溶酶增多,纤维蛋白(原)降解,形成一系列分子量由大到小的段片X、Y、D、E,总称为纤维蛋白(原)降解产物 (FDP)。FDP的主要作用是抗凝,各种FDP的段片中以Y的抗凝活性最强,D次之,X和E最弱。X段片可与纤维蛋白原竞争凝血酶,与纤维蛋白单体或其他降解产物形成多聚复合物而起抗凝作用。Y段片抑制纤维蛋白单体聚合,并与纤维蛋白单体形成不溶性复合物。D段片抑制纤维蛋白单体聚合,E段片有抗凝血活酶的作用,并与凝血酶竞争纤维蛋白原分子上的受体,抑制凝血酶从纤维蛋白原分子分解出纤维蛋白A肽、B肽,阻断纤维蛋白单体的形成。因此,FDP通过较强的抗凝作用而引起出血。
(2) 循环功能障碍——休克: DIC常伴有休克,特别是急性DIC。 重度及晚期休克也可促进DIC的形成,二者互为因果,形成恶性循环。
急性DIC常伴发休克,是由于毛细血管和微静脉中有广泛血小板聚集或纤维蛋白微血栓形成,以致回心血量严重不足,再加上心肌损伤,广泛出血所引起的血容量减少等因素,使有效循环血量严重下降,心输出量减少。与此同时,中心静脉压也往往降低。但若肝和肺内有广泛微血栓阻塞,则又可相应地引起门静脉压和肺动脉压升高。前者的临床表现为肠道淤血和水肿,后者为右心排血障碍。此外,在DIC的形成过程中,由于凝血因子XII被激活和继发性纤溶的启动,使循环中纤溶酶增多,FDP形成。与此同时,激肽和补体系统也相继被激活(图2)。激肽和某些补体成分能使微动脉及毛细血管前括约肌舒张,从而外周阻力显著降低,动脉血压下降。激肽、补体裂解产物C3a,C5a和FDP均能使毛细血管通透性升高。在凝血酶的作用下,从纤维蛋白原上脱下的A肽、B肽可使微静脉及小静脉收缩,从而使毛细血管后阻力增加,加重毛细血管中的淤血和血浆的外渗,有效循环血容量显著降低,促使休克发生。
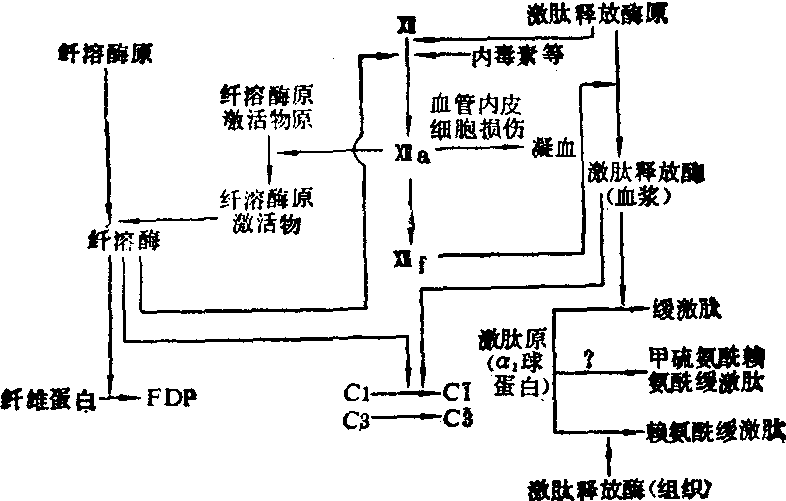
图2 凝血、纤溶、激肽与补体系统间的关系
各种休克发展到一定阶段也往往可以伴发DIC。这首先是因为引起休克的很多原始病因也是引起DIC的原因,如创伤、感染(内毒素)、过敏、血型不合的输血等。其次,这些因素对机体造成的强烈刺激,可激发交感神经系统和垂体前叶-肾上腺皮质系统功能活动增强,引起应激反应。此时血液处于高凝状态,表现为血中凝血因子增加,血小板聚集性增强,从而促进DIC的形成。最后,由于休克时血管的强烈痉挛,微循环血流缓慢甚至淤滞,严重的缺血、缺氧,代谢性酸中毒的进行性加重,都可引起血管内皮细胞的损伤而促进DIC的发生。
(3) 微血栓造成脏器功能障碍——内脏功能衰竭:DIC病人尸检或活检时,常发现微血管(毛细血管和微静脉)内有血栓存在。这种血栓可由血小板组成,但大部分为纤维蛋白微血栓。后者组织学上苏木素染色呈均匀的嗜酸性染色,接近透明,故又称透明血栓。在某些情况下,虽然有典型的DIC临床表现,但病理检查却未发现阻塞性微血栓。这可能是体内纤溶系统被激活,使微血栓在生前或死后被溶解所致; 也可能是纤维蛋白微血栓尚未形成,还停留在亚显微结构阶段,只有在电子显微镜下才能见到。曾有人在猴实验中获得这方面的证据。此外,还有人认为,如在毛细血管中发现嗜苏木素的紫色小体,也可作为DIC的证据。这种小体在肾和肺中较易见到。在肺里,它们呈圆形或卵圆形,聚集形成团块。总之,这些病理变化的存在都是引起DIC病人脏器发生栓塞及功能衰竭的病理学基础。
在微血管中形成的微血栓,可阻塞相应部位的微循环血流,严重时可造成实质性脏器的局灶性坏死。如果此过程较为严重或持续过久,坏死性病变可成为个别脏器功能衰竭的原因。例如在肾脏可出现双侧肾皮质坏死和急性肾功能衰竭,临床上表现为少尿、蛋白尿、血尿等。在肺部可引起呼吸困难、紫绀、肺出血,从而导致肺功能衰竭。消化系统的病变可导致恶心、呕吐、腹泻、消化道出血。肝受累时出现黄疸及肝功能衰竭。内分泌腺的病变最常见者如肾上腺皮质出血性坏死造成的急性肾上腺皮质功能衰竭,称华-佛 (Waterhouse-Friderichsen)综合征,垂体坏死可导致Sheehan综合征,神经系统的病变可导致神志模糊、嗜睡、昏迷、惊厥等。
DIC时由于凝血及纤溶的轻重程度不一,在不同的病人及病程的不同阶段可有不同的表现。此外,DIC范围大小不一所造成的后果也不同,轻者仅影响个别脏器的部分功能,重者可引起一个或多个脏器的功能衰竭,甚至造成死亡。
在DIC发展中,有时在较大的微血管中,还能见到一些大小不等的由纤维蛋白、血小板和(或)红白细胞组成的团块。这种团块可能是正在形成中的流动血栓,也可能是脱落的微血栓栓子,它们可以堵塞某些微血管,从而引起相应组织和器官的功能障碍。这就是微栓塞综合征。但如它们顺着血流继续增大,最后可能阻塞重要器官的微循环,引起急性栓塞症状,甚至导致骤然死亡。
(4) 红细胞机械性损伤引起的溶血——微血管病性溶血性贫血: DIC伴发的一种特殊类型的贫血。这种贫血除具备溶血性贫血的一般特征外,外周血涂片可发现有小的球形红细胞及各种形态的红细胞碎片,如盔甲形、星形、新月形、小球形等。这些碎片,由于脆性高,容易发生溶血。
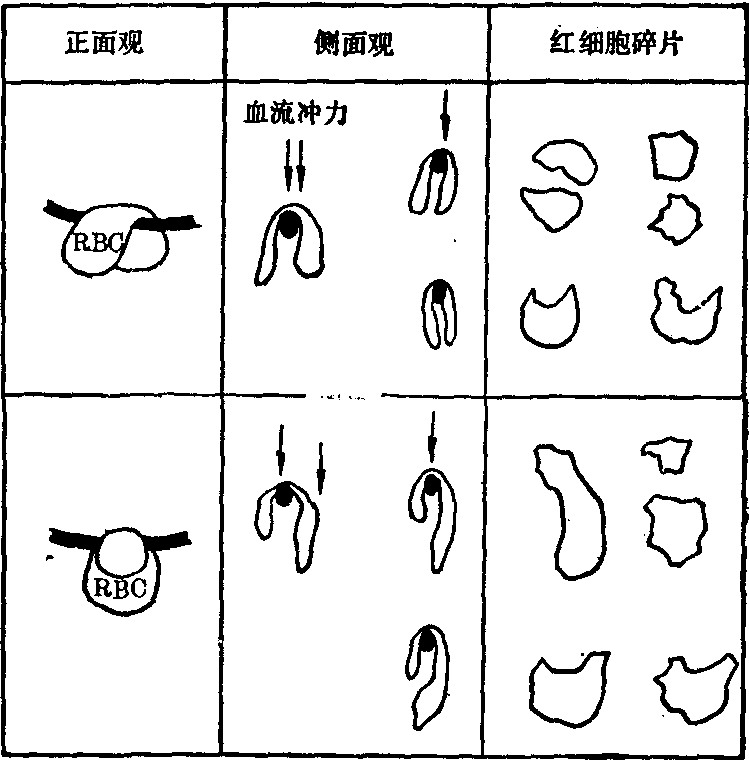 图3 红细胞碎片的形成黑线处为纤维蛋白丝
图3 红细胞碎片的形成黑线处为纤维蛋白丝
目前认为产生红细胞碎片的原因虽然很多,但DIC是主要因素。其形成机制主要是当微血管中有纤维蛋白微血栓形成时,纤维蛋白在微血管腔内形成网状条索,当循环中的红细胞粘着或滞留在纤维蛋白条索上之后,由于血流的不断冲击,引起红细胞破裂(图3)。在微血流通道发生障碍时,红细胞还可能通过肺组织等的微血管内皮细胞间的裂隙,被“挤压”到血管外组织中去。这种机械损伤同样也可使红细胞扭曲、变形和碎裂。此外,在红细胞扭曲,变形和碎裂过程中可出现继发性球形细胞增多症。球形细胞的脆性增高,容易破裂而发生溶血。所以在DIC病人中有时可以出现溶血的一系列临床表现和实验室检查结果,包括外周血涂片中的红细胞碎片。
播散性血管内凝血
播散性血管内凝血(DIC)是一种综合征,可发生在许多疾病,其特点为在某些诱发因素作用下,微循环中广泛而散在地发生血小板聚集、纤维蛋白沉积或血液凝固,导致血小板和凝血因子被大量消耗,继而纤维蛋白溶解(纤溶)系统被激活,临床上出现各受损脏器的功能障碍以及广泛和严重的出血。
病因 许多种疾病或病理状态均可引起DIC。
(1)感染:
❶细菌感染: 革兰阴性菌,如脑膜炎球菌、大肠杆菌、变形杆菌、绿脓杆菌性败血症,急性菌痢等;革兰阳性菌,如金葡菌、溶血性链球菌性败血症等;
❷病毒感染: 流行性出血热、重症肝炎、麻疹、流感、登革热等。
❸立克次体感染: 斑疹伤寒等;
❹螺旋体感染: 钩端螺旋体病等;
❺原虫感染: 恶性疟疾等。
(2) 妊娠及分娩并发症: 羊水栓塞、感染性流产、用高渗盐水或天花粉于妊娠后期作人工流产、前置胎盘、死胎潴留、妊娠毒血症、葡萄胎、子宫破裂。
(3)创伤、外科疾病及手术: 胃、肺、胰腺、前列腺、胆道等手术,大面积烧伤、挤压伤、骨折、体外循环、毒蛇咬伤、肾移植排斥反应、巨大海绵窦血管瘤、脑组织损伤。
(4)癌肿: 肺、乳房、胃、结肠、胰腺、前列腺、卵巢等癌肿转移,急性白血病尤其是急性早幼粒细胞白血病,恶性组织细胞增生症。
(5)儿科疾病: 新生儿感染、严重特发性呼吸窘迫综合征、溶血尿毒症综合征、新生儿窒息、新生儿硬肿症。
(6)内科疾病:
❶心血管系统疾病: 休克(尤其是感染性休克)、恶性高血压、紫绀型先天性心脏病、肺梗塞、脂肪栓塞;
❷免疫性疾病: 溶血输血反应、药物过敏反应、红斑性狼疮;
❸消化系统疾病: 肝硬化、急性出血性胰腺炎;
❹其他: 中暑、热射病、暴发型紫癜、血栓性血小板减少性紫癜、肺肾出血综合征、巨大海绵窦血管瘤、一氧化碳中毒。
在以上各种病因中,感染最多见,约占25~40%,外科手术、创伤占15~17%,癌肿占6~20%,产科意外占7~10%,其他疾病占15~30%。
发病机理
❶外源凝血系统被激活: 如大面积烧伤,肺、胃、胰腺等大手术,癌肿播散,羊水栓塞,挤压伤等过程中,大量组织因子进入血液循环,激活外源凝血系统;
❷内源凝血系统被激活: 主要发生在血管内皮广泛受到损伤,因子XII被激活,启动内源凝血系统,如病毒、细菌内毒素、缺氧、高乳酸血症性酸中毒广泛损伤血管内皮细胞。胰蛋白酶可以直接激活因子XI启动内源凝血系统;
❸其他促凝物质的作用: 如抗原抗体反应可激活因子XII或使血小板聚集,白细胞促凝物质(如早幼粒细胞白血病的颗粒)、蛇毒、红细胞素(溶血性输血反应时释放)等都可促进血液凝固。血小板被免疫复合物、凝血酶等被激活后发生聚集,释放血小板因子3(PF-3)是促进血管内血液凝固的重要因素之一。
下列各因素有利于DIC的发生:
❶单核巨噬细胞系统的功能受抑制,肝的灭能功能受损,如重症肝炎、应用大剂量肾上腺皮质类固醇;
❷高凝状态: 生理性(如妊娠末期)或病理性凝血因子增高,血小板粘附聚集性增高或纤溶系统被抑制(如不恰当地应用大量抗纤溶药);
❸DIG的“启动阈”下降: 如见于缺氧、酸中毒、血粘度增高、营养状况差、年龄小或老年人。
临床表现 除原发病的症状和体征外,DIC的临床表现可归纳为以下四方面(见图):
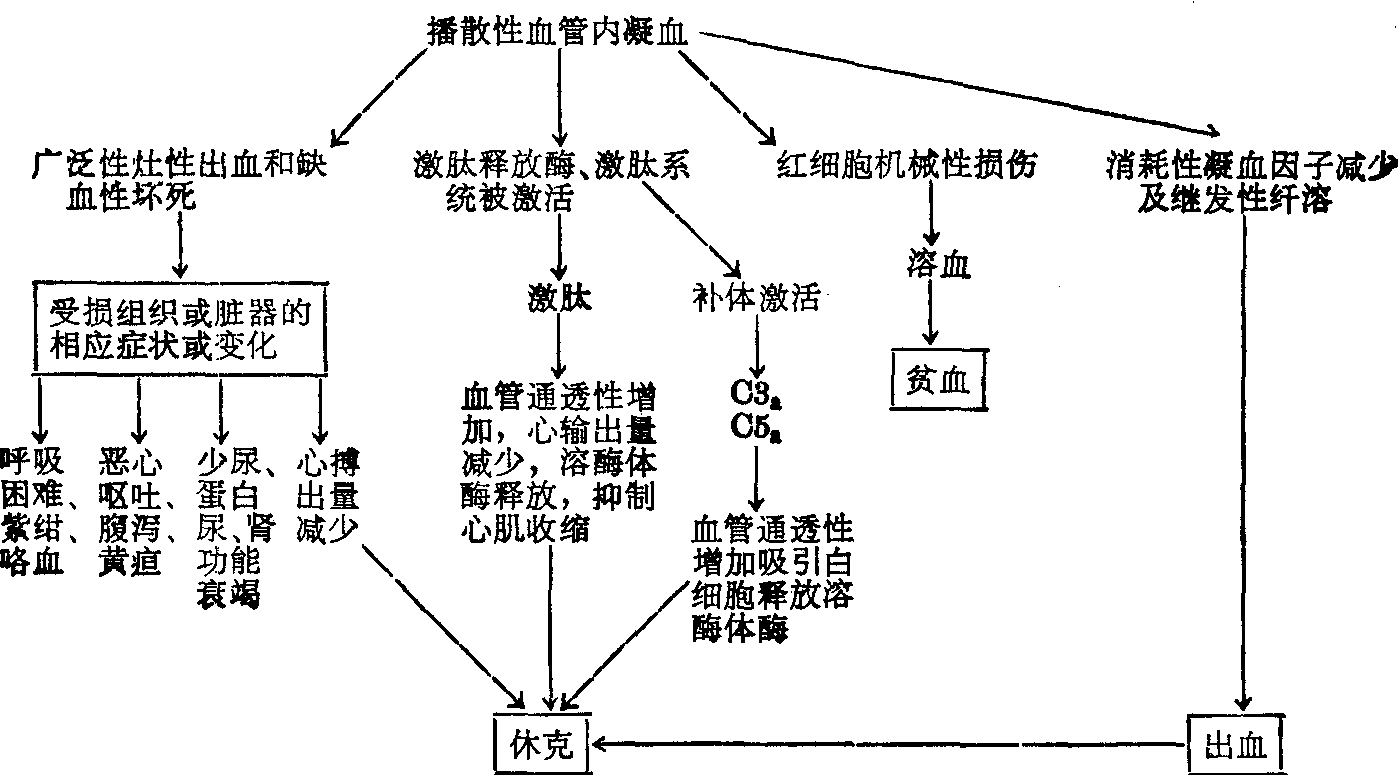
DIC的临床表现图解
(1)脏器或组织受损的症状: 由于微血管内广泛发生血小板聚集、纤维蛋白沉积或血液凝固,受损组织或脏器产生相应的症状或体征,如呼吸困难、紫绀、咯血、恶心呕吐、腹泻、黄疸、少尿、蛋白尿、无尿、心跳加快、脉细弱等。
(2)休克: 血管内皮细胞广泛受损,使因子XII、激肽释放酶、激肽系统相继激活,形成激肽,后者使血管扩张、毛细血管通透性增加,心输出量减少,破坏细胞的线粒体,抑制心肌收缩,导致休克。激肽释放酶又可激活补体系统,其产物C3a、C5a吸引中性多核粒细胞在局部聚集,释放促凝物质及溶酶体内的蛋白水解酶,导致血管内皮细胞进一步受到损伤,使DIC恶化。C3a及C5a还有过敏毒素活性,可使毛细血管通透性增加,参与休克的发生。此外,失血、微循环广泛血栓形成所致回心血量减少,心搏出量减少也都参与休克的发生。
(3) 出血: 凝血因子及血小板消耗性减少,继发性纤溶引起广泛而严重的出血。
(4) 溶血: 毛细血管中沉积的纤维蛋白网机械性地损伤红细胞,造成微血管病性溶血性贫血,临床上出现黄疸和贫血。
分期与分型 根据病理过程,DIC可分为高凝期、消耗性低凝血期及继发性纤溶期。出血症状在高凝期不明显,第二期时明显,第三期时最严重。
根据病情的缓急,DIC又可分为急性、亚急性及慢性型。急性型如发生在羊水栓塞、溶血性输血反应、体外循环、大手术时的DIC,常在数小时至1~2天内发病,病程急剧而凶险。亚急性型如见于急性白血病、癌肿播散的起病可延至数天至数周,病情较缓。慢性型如见于海绵窦状血管瘤、红斑狼疮等的起病缓慢,病程较长,出血较不严重。
诊断 DIC的诊断标准:
(1) 有诱发DIC的基础疾病。
(2) 具备下列临床表现中两项以上:
❶反复、严重或多部位出血倾向,不易用原发病解释;
❷不明原因的顽固性低血压状态或休克,伴其他微循环障碍的表现;
❸出现提示肺、肾、脑、肝、皮肤、皮下及肢体栓塞或坏死的症状和体征,其中与原发病不符合的急性肾功能不全及肺功能不全最具诊断价值;
❹用原发病不易解释的迅速发展的进行性贫血;
❺肝素或其他抗凝治疗有效。
(3) 实验室检查符合下列标准:
❶同时出现下列三项异常: 血小板减少(低于10万/μl)或进行性减低; 血浆纤维蛋白原降低(低于150mg/dl)或进行性减低;凝血酶原时间(PT)较正常(12~13秒)延长3秒以上。
❷如以上三项指标中二项不正常,则必须有下列五项中1~2项以上异常: 凝血酶时间延长5秒以上(正常16秒);鱼精蛋白副凝试验(“3P”试验) 阳性或FDP定量高于20μg/ml;KPTT*较正常高限(43秒)延长10秒以上;优球蛋白溶解时间短于70分或血浆中血浆素原定量降低;血片中可见破碎红细胞及三角形、盔形、葫芦形及棘形红细胞占2%以上。
DIC的其他实验室检查尚有血小板因子4(PF-4)、血小板β血栓球蛋白(βTG)、纤维蛋白肽A的测定,结果都增高,抗凝血酶Ⅲ(AT-Ⅲ)、因子Ⅷ凝血活性(Ⅷ:C)/因子Ⅷ相关抗原(ⅧR:Ag)降低。
防治 积极治疗原发病。在疾病过程中出现原因不明
* 白陶土部分凝血活酶时间,是测APTT时最常用的一种方法。
的高凝状态时(如血液凝固时间缩短),应警惕本病,及早处理。DIC的诊断肯定后用肝素治疗,剂量为1mg/kg,静脉滴注,每4~6小时一次,使凝血时间延长到正常的二倍。疗程视原发病而定,原发病易去除者如产科并发症所引起者,只要病因去除,DIC的症状消失,实验室检查结果基本恢复正常即可逐渐停药。DIC早期诊断未完全肯定者可用中、小剂量肝素,0.25~0.5mg/kg,每6小时一次。血小板抑制剂如双吡胺醇(潘生丁)、阿斯匹林、右旋糖酐适用于原发病因可以立即去除、病情较轻或诊断尚未肯定但DIC的可能性很大的病例。潘生丁的成人剂量为每日400~600mg加入葡萄糖液静脉滴注,分四次注射,每6小时一次。继发性纤溶期应使用抗纤溶药如对羧基苄胺、止血环酸;对已形成的血浆素,可用抑肽酶,静脉滴注4~8万u,必要时8~12小时后重复一次。此外应积极补充所缺乏的凝血因子,如输血小板、新鲜血浆或鲜血,单用肝素可使出血加重。
预后 预后严重,但随病因和病型而不同。病因在短时间内能去除者(如产科并发症),即使病情很重,抢救成功者多。病因不易去除者,如癌肿广泛转移、严重感染不易控制,预后不良。
播散性血管内凝血
播散性血管内凝血(DIC)是指发生在全身微循环内泛发性血液凝固的临床病理过程。它的发生是由于凝血因子在血循环中被广泛地激活,使血液处于高凝状态,进而在全身小血管和毛细血管内形成以纤维蛋白为主的微血栓。在临床上,微循环可因微血栓的阻塞而发生灌流量不足,导致休克或加重原有的休克,也可因重要器官微血栓所致的梗死而危及生命。由于在微血栓形成时消耗了大量凝血因子(尤其是凝血因子Ⅴ、Ⅷ、Ⅸ、Ⅹ、ⅩⅢ)、纤维蛋白原、凝血酶原和血小板,所以在泛发性凝血之后,血液即转为低凝状态,致使患者又可发生出血现象,并成为DIC的主要临床症状,因此本病又称为消耗性凝血病。此外,在本病的发展过程中,血浆中的纤维蛋白溶酶原被激活,后者可使微血栓溶解,局部小血管可以重新再通,血液遂从这些受损的血管大量逸出,从而更加重了出血程度。
DIC的主要病变为:
❶泛发性微血栓形成: 微血栓分布甚为广泛,最常见于肾、脑、垂体、肾上腺、肝和胃肠道的毛细血管、血窦和小静脉、小动脉内,但也可以相对地局限于某几个器官。微血栓的成分主要为纤维蛋白,也常含有血小板。在较大的小静脉内,也可以有红细胞成分。有的微血栓呈同质性,染色均匀一致,称为透明血栓。在DIC的过程中,由于血液凝固性的增高,以及往往同时存在的血压降低和患者卧床不动,所以除微血栓外,心内膜和大静脉也可有血栓形成。但是,在纤维蛋白溶酶原大量激活后,微血栓可被溶解,尸检时各器官内仅能发现很少量微血栓的存在。
❷器官的梗死; 某一局部广泛的微血栓形成,可以导致梗死。梗死病灶可微小,也可融合成较大面积。可为贫血性,也可为出血性梗死。
❸出血:皮肤、粘膜和实质器官可呈广泛性出血。肺和中枢神经系统的出血可以是死亡的重要原因。但在本病的早期(血液呈高凝状态时)死亡者,可以不发生出血。
DIC时各器官的病变如下:
(1) 肾: 肾小球毛细血管、入球细动脉和肾小管间细动脉发生纤维蛋白性血栓。这些微血栓可导致肾小管缺血坏死。严重者双侧肾皮质发生多发性微小贫血性梗死,小梗死也可融合成片。大多数晚期病例,双肾皮质呈广泛梗死,即肾皮质坏死。梗死周围有出血带。髓质保持正常。患者可有少尿、无尿、血尿、腰痛、血非蛋白氮增高。部分病例肾静脉也有血栓形成。
(2) 肾上腺: 肾上腺包膜的输入小动脉和球状带血窦常有纤维蛋白血栓形成,可导致肾上腺皮质多发性灶性坏死。少数病例血栓形成很广泛,使双侧肾上腺皮质皆陷于广泛性坏死。如血栓完全阻塞血窦,梗死为贫血性,否则,梗死伴有出血,成为出血性梗死。在血栓溶解后血液循环重新恢复者,出血尤为严重。肾上腺广泛的微血栓形成导致皮质坏死,尤多见于幼儿的革兰阴性菌败血症,如脑膜炎双球菌、绿脓杆菌、产气杆菌、大肠杆菌等败血症时。临床表现为华佛综合征。
(3) 垂体: 腺垂体血窦常形成微血栓。如微血栓较广泛,可导致腺垂体梗死。微血栓被溶解后,梗死灶便发生出血。如患者不死于休克,约2周后,梗死被包裹机化,再逐渐变为瘢痕组织。腺垂体较大的瘢痕,可引起腺垂体功能不足,因而继发性腺、甲状腺、肾上腺皮质等内分泌腺功能减退,这便是发生席汉综合征的机理。产程中失血过多者,产后可能发生席汉综合征,Sheehan认为这是由于失血引起了出血性休克,患者乃发生小动脉痉挛,使视丘下部血管缺血,下视丘垂体门静脉因之血量减少,腺垂体乃发生缺血以致坏死。近年认为,席汉综合征的发生,更主要的是由于产程中的DIC。胎盘早期剥离是DIC常见原因之一,DIC的发生,虽然和失血性休克有关,但由于组织因子自胎盘大量逸入产妇血液,导致血浆的高凝状态,显然也是DIC的原因之一。此外,DIC的发生不仅限于产程中之失血,子痫、羊水栓塞、感染性休克等也都可以激活凝血过程,引起DIC和垂体坏死。患者血浆纤维蛋白原浓度甚低,垂体血窦和其他内脏皆可见到微血栓。
(4) 心脏: 在心瓣膜边缘形成由纤维蛋白、血小板和红细胞组成的赘生物,赘生物可小于3mm,也可大到1.5cm左右。可单发性,但常为多发性。约1/2的病例单独发生于二尖瓣,1/5的病例单独发生于主动脉瓣,1/5的病例同时发生于二尖瓣和主动脉瓣。发生于三尖瓣和肺
动脉瓣者甚少。赘生物内不含细菌。以前人们不知道这种心内膜赘生物形成的机理和意义,称这种改变为非细菌性血栓性心内膜炎、衰弱性心内膜炎、临终性心内膜炎、单纯性心内膜炎和变性的疣性心内膜炎。
DIC时,虽然血液凝固性的增加是心内膜血栓形成的直接原因,但绝大多数病例,血栓的形成仍然发生于心瓣膜原有疾患(例如粥样硬化或高血压病的心瓣膜增厚和心瓣膜胶原纤维变性,愈复了的风湿性心内膜炎等)的基础上。发生于正常心瓣膜者很少见。
DIC时心瓣膜血栓形成,约1/2病例发生于恶性肿瘤患者,其次为充血性心力衰竭。在恶性肿瘤中以胃癌为最常见。在心瓣膜病变的同时,也常有下肢静脉、心壁内膜和微循环的血栓形成。心瓣膜赘生物脱落也可以导致外周器官的梗死。
(5) 肺: 肺动脉小分支、细动脉、毛细血管以及肺静脉小分支内可有微血栓形成,支气管动脉分支则因血压较高,流速较快,不易形成血栓。在肺动脉系统的血栓很广泛时,可以见到支气管动脉分支的显著扩张。在紫绀型先天性心脏病手术后发生DIC者,由于患者肺循环已有血流缓慢,在缺氧血症因素所致的血液凝固性增高的作用下,肺内特别容易发生血栓。这时,肺有广泛性微血栓而其他器官可以没有。微血栓形成时大量消耗凝血因子,患者术后数小时在手术创口可发生大出血。
(6)脑: 脑内小血管和毛细血管有纤维素性血栓和血小板血栓,小血管周围发生环状出血,尤以室管膜下为显著。严重病例,患者因之出现抽搐和昏迷。在脑实质形成微血栓的同时,部分病例还可发生矢状窦血栓、脑内静脉单个或多个节段性附壁血栓。血栓形成引起患者颅内压升高,临床出现头痛、呕吐和视乳头水肿。如为节段性血栓,再视血栓涉及部位不同而有不同的相应症状。
(7) 胃肠: 胃肠粘膜经常发生微血栓,因而粘膜的多发性出血性梗死是经常或必然出现的。梗死限于粘膜,不涉及肌层。临床可有呕血、血便或隐血。DIC可导致假膜性肠炎,多在结肠癌手术后发生。在坏死的粘膜,许多小血管内可见微血栓,后者是粘膜坏死并继发假膜形成的原因。DIC引起的假膜性肠炎和金黄色葡萄球菌引起的假膜性肠炎不同,后者有使用广谱抗菌素的病史,起病以腹泻为主,待大量失水后才出现休克。DIC引起的假膜性肠炎,多继发于手术后,骤然起病,迅即出现严重休克,腹泻却可有可无。
(8)肝: 常发生灶性坏死。在子痫和胎盘早期剥离患者,灶性坏死以位于小叶外围带为特征,这是由于肝动脉的小叶外围终未分支的血栓形成所致。在一些其他原因引起的DIC,小叶内的窦状隙和中央静脉、叶下静脉分支形成血栓,肝的灶性坏死的形状、大小和位置均不同。肝的灶性坏死,不致引起肝功能衰竭。
(9)大静脉: 大血管(尤为静脉)亦可有血栓形成。这种情况主要见于癌肿,但在血小板增多症、后天性溶血性贫血、子痫等亦偶可发生。
- 沈叔羊是什么意思
- 沈叔羊是什么意思
- 沈召春是什么意思
- 沈右是什么意思
- 沈同午是什么意思
- 沈同芳是什么意思
- 沈向奎是什么意思
- 沈吕九是什么意思
- 沈吕巡是什么意思
- 沈君公是什么意思
- 沈君山是什么意思
- 沈君权是什么意思
- 沈君理是什么意思
- 沈君神道阙是什么意思
- 沈启无是什么意思
- 沈启绵是什么意思
- 沈启贤是什么意思
- 沈周是什么意思
- 沈周是什么意思
- 沈周是什么意思
- 沈周是什么意思
- 沈周是什么意思
- 沈周是什么意思
- 沈周是什么意思
- 沈周是什么意思
- 沈周(1427—1509)是什么意思
- 沈周两江名胜图册是什么意思
- 沈周写生册是什么意思
- 沈周的传说是什么意思
- 沈周自题溪山秋色引首是什么意思
- 沈周行书七律诗轴是什么意思
- 沈命法是什么意思
- 沈和中是什么意思
- 沈哲臣是什么意思
- 沈哲鲲是什么意思
- 沈善圭是什么意思
- 沈善洪是什么意思
- 沈善炯是什么意思
- 沈善燮是什么意思
- 沈善登是什么意思
- 沈善登是什么意思
- 沈善登(1830—1902)是什么意思
- 沈嗣良是什么意思
- 沈嗣良是什么意思
- 沈嗣良是什么意思
- 沈嘉炎是什么意思
- 沈嘉瑞是什么意思
- 沈嘉瑞是什么意思
- 沈嘉瑞(1902—1975)是什么意思
- 沈囊是什么意思
- 沈园是什么意思
- 沈园是什么意思
- 沈园·陆游纪念馆是什么意思
- 沈国成是什么意思
- 沈国成是什么意思
- 沈国明是什么意思
- 沈国柱是什么意思
- 沈国梁是什么意思
- 沈国舫是什么意思
- 沈国荣是什么意思