微丝microfilament
细胞质内直径为5~8nm的纤维状蛋白结构。比居间丝细,参与细胞骨架组成,是细胞运动的两大系统之一。
组成 主要成分为肌动蛋白,是一条由376个氨基酸残基组成的单链多肽,分子量为41 000。在细胞内结合1个ATP和1个作为辅基的Ca2+而成为G-肌动蛋白,分子量43 000,呈分散于细胞质内的球状单体。它存在于所有真核细胞内,在运动性细胞中(如变形虫和血小板)含量达总蛋白的20~30%,在非运动性细胞如哺乳动物肝细胞中仅含1~2%。
据一级结构分析,所有后生动物的肌动蛋白均是原生动物和真菌的细胞质肌动蛋白的进化后代。脊椎动物肌肉中的肌动蛋白分化成心肌型、骨骼肌型、脉管型和肠道型,无脊椎动物则直接利用细胞质肌动蛋白组成肌肉。植物较早分化,其微丝的肌动蛋白与动物和真菌不同。
结构与分类 G-肌动蛋白在合适的条件下可自装配成丝状F-肌动蛋白,并由两根F-肌动蛋白缠绕成双螺旋结构,即微丝,其一端不断有肌动蛋白单体解聚下来,另一端不断有新的G-肌动蛋白聚合上去。细胞有多种蛋白分子能调节肌动蛋白的结构状态。有的与单体结合,以阻止其装配;有的结合在微丝两端,以中止其延长和缩短; 有的能切断微丝; 有的使微丝交织成网或并合成束; 有的可使微丝与膜性构造结合。
细胞松弛素B是一种真菌产物,它能作用于F-肌动蛋白,阻止微丝的装配,故为研究的工具药物。另有几种蛋白质能调节微丝的运动功能,如原肌球蛋白与肌动蛋白结合后,能阻止后者与肌球蛋白形成复合物而引起运动反应; 肌宁蛋白则使原肌球蛋白与肌动蛋白脱离,以解除对运动的抑制作用。在肌肉细胞中,与原肌球蛋白和肌宁蛋白结合的微丝,即肌原纤维的细肌丝,长约1.1μm,一端游离,另一端固定在由居间丝如结蛋白丝和α-肌动宁蛋白等组成的Z盘上。非肌肉细胞中,虽无肌宁蛋白,而原肌球蛋白仍与肌动蛋白结合,有稳定微丝结构、防止自发切断的作用。非运动性细胞,α-辅肌动蛋白、原肌球蛋白和肌球蛋白以不同的周期结合在微丝上,几百条这种微丝并合起来,组成应力纤维,固着于致密斑。
肌球蛋白及其组成的纤维结构是微丝执行运动功能时的重要合作者。因肌动蛋白本身虽亦具腺苷三磷酸酶(ATP酶)活性,但它水解ATP获能仅供自装配,而运动时所需能量则有赖肌球蛋白起ATP酶作用而提供。肌球蛋白的分子量为480,由2条重链和4条轻链组成,外形呈球棍状(2×150nm),分球头和杆身两部分,前者能与微丝相连成横桥,并起ATP酶作用,后者为自装配的部位。由一定数量的肌球蛋白可装配成具双极性的纤维结构,即类似肌原纤维中的粗肌丝。肌球蛋白的保守性不如肌动蛋白,在细胞内的含量有时极微,如鲎精子。一般非肌肉细胞中含量较微,而在肌肉细胞内则可达总蛋白量的50%以上。其结构状态亦多变,如在非运动细胞内不组成独立的纤维,仅依附于微丝,在各种运动性细胞内虽均装配成粗肌丝,但大小不一。如脊椎动物的横纹肌,直径为10~15nm,长约1.6μm,无脊椎动物的横纹肌,直径为15~25nm,长约1.8μm(海扇缩足肌)。
功能与作用机制 微丝是组成细胞骨架的主要成分之一,以维持细胞特定的形态,并抵御环境的应力。在某些情况下可形成应力纤维,以增加细胞体的机械强度,应付较大的剪切力,如血管内皮细胞和离体培养贴壁生长细胞等。在非运动性细胞中,是推动细胞质流动、细胞吞吐、细胞器趋性反应、膜流等的主要机构; 亦积极参与细胞分裂过程,尤其在胞质分离时起主要作用; 在吸收性或排泄性上皮细胞内,它分布在微绒毛中,引起伸缩和摆动,以控制物质运输效率。在运动性细胞中,如变形运动、血小板凝血时的收缩反应和某些动物精子的顶体突起反应等均由微丝引起。肌肉细胞是专职的运动细胞,它具有的肌节是微丝结构最严密的形式。由微丝组成的细肌丝排列成六边形晶格,由肌球蛋白组成的粗肌丝形成三角形晶格,两种肌丝交错排列时,每条粗丝恰好位于6条细丝所构成的六边形中央,而每条细丝又被3条粗丝所包围。这两种肌丝之间的相对滑行动作是一切肌肉收缩运动的分子基础,其运动效率很高,如人肌细胞能将20~25%的化学能(有时达41%)转化成机械能。当肌细胞膜受运动神经刺激后,引起胞质内Ca2+浓度瞬时升高,使粗丝周边伸出的球头与相邻细丝结合而形成横桥,这种肌动-肌球蛋白复合体起ATP酶作用,水解ATP而使横桥移位并脱开,从而推动两种肌丝间的相对位移,整个肌节缩短。膜兴奋状态结束,胞质Ca2+浓度重新下降,粗—细肌丝间联系中断,肌节松弛而恢复原有长度(见图)。
每个肌节从静息到兴奋约可缩短1μm,故肌肉缩短1cm时需有10 000个连续的肌节同时参与运动。收缩时能产生1~10kg/cm2的力。
各种肌细胞结构与收缩速度和作功效率的比较
| 类 型 | 细胞大小 (直径×长度)(μm) | 肌节长度 (μm) | 细肌丝:粗肌丝 | 缩短率 (%) | 收缩频率 (次/秒) | 产生张力 (kg/cm2) |
| 脊椎动物横纹肌 | 50×5 000 | 2.4左右 | 2:1 | |||
| 快 肌 慢 肌 | 15 60 | 500 33 | 1~2 5~10 | |||
| 软体动物闭壳肌 | 5×? | 0 | 12:1 | 闭合20~30天不松劲 | 15.0 | |
| 甲壳动物位相肌 紧张肌 | 4 8 | 30~60 10~20 | 0.8 5.0 | |||
| 昆虫飞翔肌 | 50~1 000×? | ? | 3:1 | 1~3 | 100~3 000 | 0.25 |
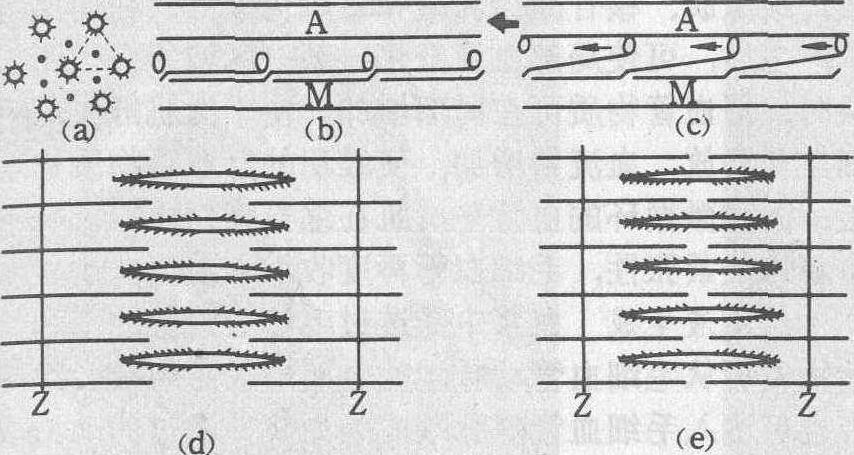
粗肌丝与细肌丝间的相对滑行及肌节收缩示意图(a) 两种肌丝间的排列晶格(肌节横截面);(b) 静息时粗、细肌丝相互分离; (c) 兴奋时粗、细肌丝间形成横桥并相对滑行;(d) 松弛的肌节;(e) 收缩的肌节; A. 细肌丝;M. 粗肌丝; Z. Z盘
各种肌细胞的结构不同,收缩速度和作功效率也不同(见表)。
微丝micro filament
真核细胞内主要由肌动蛋白构成的细丝。直径4~7 nm。常成束平行排列,可形成规则的稳定结构,或呈网状排列于细胞膜下。细胞松弛素B等药物可结合于微丝的端点,阻断继续连接肌动蛋白单体,并可使已形成的微丝网络解聚;鬼笔环肽等可促进微丝聚合并稳定结构。微丝常随不同的细胞周期,以及细胞的生理状况变化而聚合或解聚。细胞骨架的主要成分之一,对维持细胞形态、在细胞运动、收缩、吞噬、分裂和胞质流动等细胞生命活动中起重要作用。
微丝microfilament
细胞质中所含有的细丝状结构叫微丝。其直径很细,多在100Å以下,有些微丝聚集成束,经特殊染色后可在光学显微镜下见到,称为原纤维,见于上皮细胞内的张力原纤维、肌细胞内的肌原纤维、神经细胞内的神经原纤维等。上皮细胞表面的纤毛、精子的尾部和听细胞的静止纤毛亦含有微丝。
微丝
许多真核细胞(包括所有的免疫细胞)胞质内的长约5—8纳米的细丝。由螺旋式聚合的肌动蛋白组成。与细胞的运动、吞噬作用、吞噬体和溶酶体的融合、细胞的外排作用和细胞分裂等有关。
微丝microfilament
是一种常见的细胞器,由肌动蛋白组成,直径5~7nm。它与细胞的多种功能有关,如肌纤维收缩、巨噬细胞吞噬、腺细胞分泌等。还有一种直径为10~15nm的细丝,如上皮细胞中的张力细丝、神经原纤维中的神经丝等,有时亦称微丝,主要起支持作用。
微丝
由肌动蛋白构成的微丝,不只在肌细胞内作为收缩运动的主要成分,也普遍存在于一般细胞内,作为细胞骨架和运动的主要成分。
在50年代曾从多核变形虫或血小板提出肌动肌球蛋白类似物,随生物化学技术的进展,已从多种非肌细胞中提纯肌动蛋白和肌球蛋白。以免疫组织化学方法,利用提纯肌动蛋白诱制的抗体,可显出组织培养细胞质内肌动蛋白呈直束状布满细胞质内,称为“应力纤维”。或用提纯的重酶解肌球蛋白(HMM),加至经甘油提取过的细胞内,则在肌动蛋白的微丝上,显示出“箭头”状的侧突,和在肌细胞内的肌动蛋白上所见的一样,按一定距离整齐排列。在电子显微镜下,肌动蛋白微丝是直径为6~7nm的细丝,单独或成束分布在胞质中。在高电压电子显微镜下,可看到培养细胞的薄突胞质内有微丝交织的网,附在各种颗粒体上。或用洗涤剂将细胞膜破坏,使细胞质内可溶的蛋白质去掉,干燥后在电子显微镜下也可见到由微丝构成网状结构的立体形象,这些结构叫做“微小梁网”。在高倍放大时,可见微丝上有5~6nm周期性的横纹,大小相当肌动蛋白的球形亚单位,与纯肌动蛋白微丝上所见一样。构成细胞骨架的“应力纤维”或“微小梁柱”主要成分是肌动蛋白。用免疫荧光组织化学方法,可在停止运动的细胞质内显示肌球蛋白成束分布在细胞质内,与肌动蛋白所显示的“应力纤维”分布一致,但呈点状按一定间隔分布在纤维上。如细胞正在运动,则肌球蛋白弥散在细胞质内。化学分析表明细胞内含肌球蛋白较肌动蛋白少,在电子显微镜下很难显示出肌球蛋白,有时见到直径约13~22nm、长约0.7μm的微丝,疑是肌球蛋白。肌球蛋白大小和成分变异很大。其它与收缩有关的原肌球蛋白、α-辅肌动蛋白都可用免疫荧光组织化学方法显示它们在细胞内分布与肌动蛋白一致。
肌动蛋白微丝的收缩能使细胞完成各种运动,如变形运动,伪足和突起的形成与回缩,细胞内胞质周流,胞质分裂的分裂沟的环缩,吞噬作用,吞饮作用和胞吐作用等。细胞松弛素B使肌动蛋白解体,同时以上各种细胞运动停止。
小肠上皮的微绒毛的轴心有成束的微丝,微丝末端固着在微绒毛的顶端致密物质内。如经重酶解肌球蛋白处理,再以鞣酸固定,可见“箭头”式侧突向逆顶端方向均匀排列。微丝上每隔33nm有横桥连接在微绒毛的细胞膜上。微丝在微绒毛基部伸入上皮细胞顶部的终末网,与它的横行微丝相混。在微绒毛中,未能显示α-辅肌动蛋白,但有另一种多肽,分子量为95,000,叫做绒毛蛋白。有实验间接提示,它可能是连接肌动蛋白和细胞膜的特殊蛋白。在终末网中可显示肌球蛋白、原肌球蛋白和α-辅肌动蛋白的存在。以上说明,微绒毛中的肌动蛋白微丝以细胞膜为固着点,象肌纤维中的肌丝一样,与终末网的肌球蛋白彼此互相滑动,引起微绒毛的收缩。
变形运动常见于白细胞,细胞附着在固体支持物上,伸出伪足向前移动。伪足的细胞质可分为凝胶状的外胞质和溶胶状的内胞质。在外胞质中有肌动蛋白微丝和肌球蛋白集聚成束,它们的收缩致使外胞质局部收缩,内胞质向前流动,同时内外胞质互相转变使细胞局部阻力强弱交替转化,这些因素是复杂的变形运动的主要机理。
微丝
微丝通常为直径7nm的胞质纤维,主要化学组成为肌动蛋白,是分子量为43 000的球蛋白,每个单体带有一个ATP。肌动蛋白在一切真核细胞及部分原核细胞中是一种极为保守的蛋白质。在高等原核生物是由一组相类似的基因编码的。微丝在维持细胞的形态、执行肌细胞的收缩活动和完成细胞吞噬和变形运动上起着重要作用。
微丝是由肌动蛋白亚单位聚合而成的双股螺旋。纤维两端的装配所要求的起始浓度不同,故也具有正负极性(图)。微丝的体外聚合可受到亚单体浓度、递质pH、钙离子、镁离子、氯化钠等因素及一些特异性药物的影响。细胞松弛素B能够可逆性地将微丝打断,从而抑制依赖于微丝的细胞功能。通常只有30%肌动蛋白处于聚合态,其余组成可溶亚单位蛋白库。多种结合蛋白在微丝的装配、组织和功能方面起着重要的调节作用。
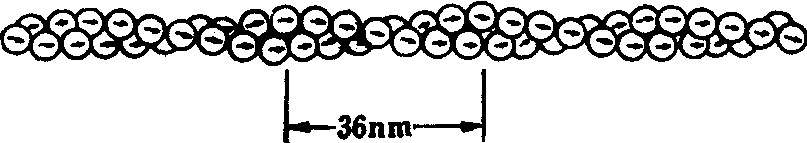
微丝是肌动蛋白单体装配成的双螺旋纤维,具有极性
微丝是细胞形态重要的支持结构之一,并与细胞膜有最密切的联系。在人成熟红细胞、肌动蛋白短纤维与血影蛋白编织成网并经过锚蛋白和带3蛋白固着在质膜上。在其他细胞中也有类似的膜支架。肌动蛋白纤维束和大致上呈周期分布的结合蛋白共同构成的应力纤维通常分布于质膜内面,它与膜外的纤粘蛋白互相依存并形成复合物。在应力纤维沿线的某些点,特别是端点,通过纤粘蛋白与膜连接并形成细胞对附着基质的粘着斑。这些结构都与细胞的粘着、铺展及迁移有密切关系。在癌化细胞中,应力纤维崩解或减少,纤粘蛋白和粘着斑减少或丧失。癌细胞从而得以从原发部位脱离和转移。
同向平行排列的微丝束组成小肠上皮刷状缘绒毛或体外培养细胞表面微绒毛的核心。这些微绒毛可增加必要的细胞表面。
肌肉细胞含有相间平行排列的肌肉粗丝和细丝。细丝即是肌动蛋白双股螺旋纤维,同时有原肌球蛋白和肌钙蛋白参加。粗丝则是肌球蛋白的多聚体。肌球蛋白的头部具有ATP酶活性,这种活性是被肌动蛋白激活的。在水解ATP的同时,肌球蛋白的头部反覆发生构象改变及与肌肉细丝接触——脱开,从而造成粗、细丝之间的滑动并由此导致肌肉收缩。这种肌动—肌球蛋白系统是绝大多数动物体内最主要的产生机械力的分子反应系统。非肌肉细胞中的一些活动,如胞质分裂时分裂环的收缩等也是由类似的滑动机制驱动的。应力纤维具有与肌小节近似的结构,但它不发生生理收缩,仅提供细胞贴附和铺展所需的张力。
肌动蛋白纤维被某些结合蛋白所复联,即可呈现凝胶状态。反之,当这些联结或肌动蛋白纤维本身被打断,则呈溶胶状态。某些种结合蛋白以很低的分子比即可促成肌动蛋白凝胶态与溶胶态之间的转化。胞质环流、细胞吞噬和变形虫运动虽然各有不同的具体机制,但都与肌动蛋白溶胶与凝胶之间的相互作用,以及溶凝胶之间的转化有关。此外,肌动蛋白也是神经轴浆的慢速转运成分。
微丝
microfilament
- 王宿人是什么意思
- 王寀是什么意思
- 王寀(《全宋词》ⅱ:697)是什么意思
- 王寀《浪花》 - 宋山水诗赏析是什么意思
- 王寂是什么意思
- 王寂
❷是什么意思 - 王寂❶是什么意思
- 王寄一是什么意思
- 王寅是什么意思
- 王寅旭是什么意思
- 王寅生是什么意思
- 王寅生(1)是什么意思
- 王寅生(2)是什么意思
- 王寅章是什么意思
- 王富洲是什么意思
- 王富海是什么意思
- 王富珍是什么意思
- 王富茂是什么意思
- 王富贵是什么意思
- 王富郎与蔡品争扭案是什么意思
- 王富龙是什么意思
- 王寒生是什么意思
- 王寓农是什么意思
- 王寔是什么意思
- 王寧華是什么意思
- 王寨抽水站是什么意思
- 王寨村是什么意思
- 王寬是什么意思
- 王寬誠是什么意思
- 王寰洽是什么意思
- 王寵是什么意思
- 王寵佑是什么意思
- 王寵惠是什么意思
- 王寵詩卷是什么意思
- 王寶慶是什么意思
- 王寶章是什么意思
- 王寻是什么意思
- 王导是什么意思
- 王导妻是什么意思
- 王寿是什么意思
- 王寿云是什么意思
- 王寿仁是什么意思
- 王寿南是什么意思
- 王寿卿是什么意思
- 王寿卿被褐惊寒是什么意思
- 王寿宝是什么意思
- 王寿庭是什么意思
- 王寿彭是什么意思
- 王寿成是什么意思
- 王寿枏是什么意思
- 王寿泰是什么意思
- 王寿焚书是什么意思
- 王寿生是什么意思
- 王寿田是什么意思
- 王封常是什么意思
- 王射子是什么意思
- 王将明是什么意思
- 王尊是什么意思
- 王尊三是什么意思
- 王尊五是什么意思