强电解质qiangdianjiezhi
电解质的强弱没有绝对的划分标准,强弱电解质之间并无严格的界限。通常所说的电解质强弱是按其电离度大小划分的,
强电解质,是指通常情况下,电离度在30%以上的电解质,如强酸、强碱和大部分盐。
弱电解质,是指通常情况下,电离度在30%以下的电解质,如蜗酸和弱碱。
因电离常数与温度有关,而与浓度无关,所以有时还用电离常数来比较酸、碱电离能力的大小。通常认为某酸或碱的电离常数K(25℃) 大于1为强酸或强碱,即强电解质; 如果电离常数K等于1~10-4为中强电解质; 电离常数K等于或小于10-4为弱电解质。可见,强弱电解质之间还存在 一系列中间状态的电解质。
有些电解质分步电离,第一步为完全电离,而第二、三步电离又不完全,具有弱电解质的性质。例如,硫酸 一级电离几乎完企,二级电离则不完全,电离常数K2为1.2×10-2,具有中强酸的特征。但硫酸仍是强酸,因一级电离常数K1>1。
因同 一电解质在浓溶液中电离度小,表现为弱电解质的性质; 而在稀溶液中电离度大,表现为强电解质的性质。于是,依电离度大小来划分强、弱电解质,对同一电解质随浓度而变,将可能为强电解质,亦可能为弱电解质。为统一起见,一般以物质的量浓度0.1 mol·L-1为标准。
同 一电解质在不同溶剂中也可表现出完全不同的性质。如,食盐在水中为强电解质,而在极性弱的溶剂,如甲醇中,则为弱电解质。一般情况下所谓的强、蜗电解质均对水溶液而言。
强电解质和弱电解质并不能作为物质的类别,而仅仅是电解质的分类。由于其状态不同,性质也不同。强、弱电解质的区别见下表。
强电解质与弱电解质的比较
| 电解质 | 强电解质 | 弱电解质 |
| 分子类型 | 离子化合物和强极性化合物 | 多数弱极性化合物 |
| 物质种类 | 强碱、强酸和大部分盐 | 强碱和弱酸 |
| 电离过程 | 不可逆,不存在电离平衡 | 可逆,存在电离平衡 |
| 电离程度 | 几乎完全电离 | 部分电离 |
| 溶液中的微 粒(除水外) | 几乎全是离子 | 离子和分子 |
| 浓度对摩 尔电导率 ʌ的影响 | ʌ随浓度的减小而 增大,稀溶液与浓度 平方根 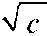 的变化呈 的变化呈线性关系。其ʌ°值可 由实验数据作图,通过外 推法求得 | ʌ随浓度的减小亦增大 但在某一稀释范围内变 化尤为剧烈。因而极限 摩尔电导率ʌ°值难以由 实验测定,可借助离子独 立运动定律计算。 |
强电解质strong electrolyte
在水溶液里能完全电离的电解质叫强电解质。强酸、强碱及其多数的盐类均为强电解质。此种电解质由于其溶液中没有分子存在,完全为可移动的离子,故导电能力强。依此原理在研制医疗仪器、治疗方法上有重要意义。
强电解质
strong electrolyte
- 解构之言是什么意思
- 解构派是什么意思
- 解枇是什么意思
- 解析是什么意思
- 解析几何是什么意思
- 解析几何学辞典是什么意思
- 解析函数是什么意思
- 解析式是什么意思
- 解析式的值是什么意思
- 解析式的定义域是什么意思
- 解析式的运算技能是什么意思
- 解析摄影测量是什么意思
- 解析摄影测量定位系统是什么意思
- 解析数论是什么意思
- 解析法是什么意思
- 解析法测算面积是什么意思
- 解析测图仪是什么意思
- 解析疑义,纠正错误是什么意思
- 解析空中三角测量是什么意思
- 解析辨考成语教学词典是什么意思
- 解林乐章是什么意思
- 解林乐章一卷是什么意思
- 解林居士是什么意思
- 解果是什么意思
- 解架是什么意思
- 解树螂是什么意思
- 解树郎是什么意思
- 解桎是什么意思
- 解桐油毒方是什么意思
- 解梦是什么意思
- 解梦卜是什么意思
- 解械是什么意思
- 解楨期是什么意思
- 解榜是什么意思
- 解榻是什么意思
- 解款是什么意思
- 解款单是什么意思
- 解款子是什么意思
- 解款簿回单是什么意思
- 解止是什么意思
- 解正新是什么意思
- 解死扣儿是什么意思
- 解毒是什么意思
- 解毒万病丹是什么意思
- 解毒丸是什么意思
- 解毒丹是什么意思
- 解毒作用是什么意思
- 解毒养阴汤是什么意思
- 解毒内托散是什么意思
- 解毒内消汤是什么意思
- 解毒凉肌方是什么意思
- 解毒凉血汤是什么意思
- 解毒化斑汤是什么意思
- 解毒化癍是什么意思
- 解毒四物汤是什么意思
- 解毒大青汤是什么意思
- 解毒天浆散是什么意思
- 解毒子是什么意思
- 解毒息风是什么意思
- 解毒承气汤是什么意思