弱电解质的电离平衡
弱电解质的电离平衡ruodianjiezhi de dianli pingheng
❶ 弱碱的电离平衡 弱碱在水溶液中部分电离,绝大部分碱以未电离的分子状态存在,因此弱碱溶液中,存在未电离的分子同电离成的离子之间的平衡。如氨水溶于水中的电离平衡为:
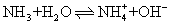
根据化学平衡原理,上述平衡可用质量作用定律来表示:
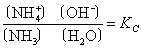
在稀溶液中,〔H2O〕可视为常数,即
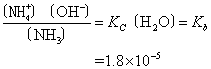
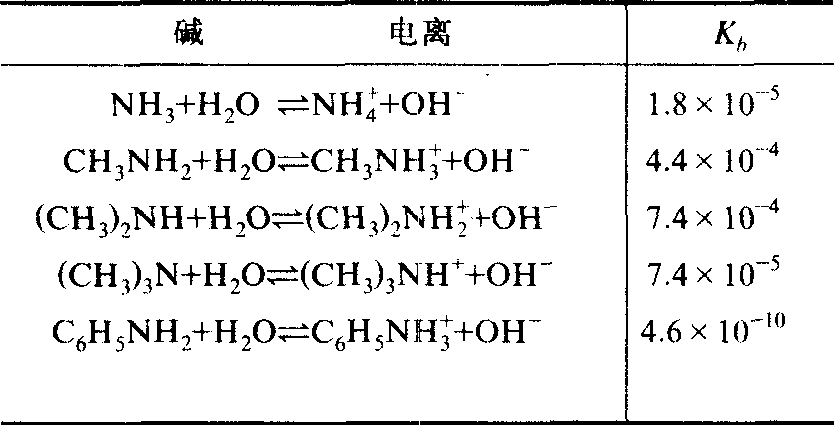
Kb称为弱碱的电离常数。某些一无碱的电离常数见表1。
表1 某些一元碱的电离常数 25℃
❷ 弱酸的电离平衡 弱酸在水溶液中也存在电离平衡,如醋酸在水溶液中的电离平衡为:
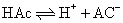
更确切的表示方法:
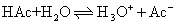
应用质量作用定律可得:
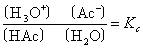
因形成H3O+所消耗的水的物质的量与稀溶液中水的总物质的量相比可忽略不计,所以水的物质的量浓度可看做常数,即
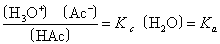
Ka称为弱酸的电离常数。Ka基本上不随浓度改变,如醋酸浓度在0.1~0.01mol·L-1范围内时,其Ka值在1.82×10-5与1.80×10-5之间。一元弱酸的电离常数见表2。
表2 一元弱酸的电离常数 25℃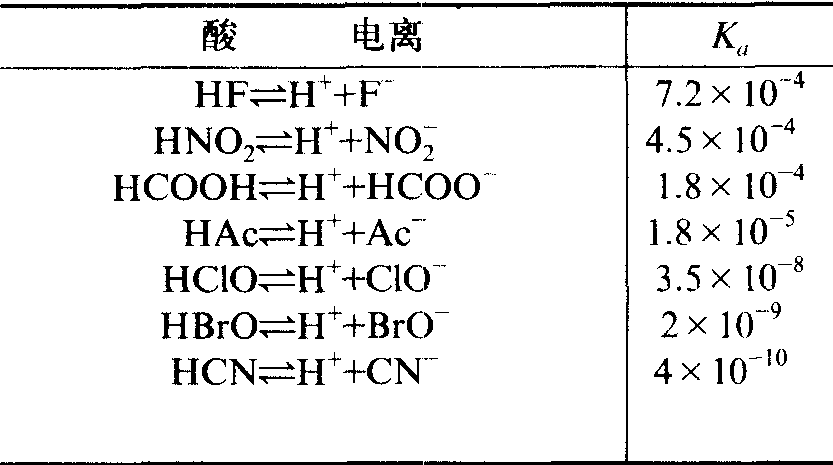
❸ 多元弱酸的逐级电离常数 多元弱酸的电离是分级进行的。以磷酸为例,其电离过程按以下三步进行:
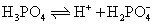
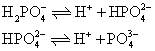
可见在磷酸溶液中,同时有3个平衡,因此有3个电离常数:
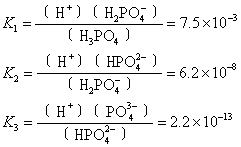
K1,K2,K3分别为磷酸的一级电离、二级电离和三级电离的电离常数。多元弱酸的逐级电离常数见表3。
表3 多元弱酸的逐级电离常数
| 酸 | K1 | K2 | K3 | K4 |
| H3AsO4 | 5.6×10-3 | 1.7×10-7 | 3.9×10-12 | |
| H3BO3 | 7.3×10-10 | 1.8×10-13 | 1.6×10-14 | |
| H2CO3 | 4.3×10-7 | 5.6×10-11 | ||
| H2S | 9.1×10-8 | 1.1×10-12 | ||
| H3PO4 | 7.5×10-3 | 6.2×10-8 | 2.2×10-13 | |
| H4P2O7 | 1.4×10-1 | 3.2×10-2 | 1.7×10-6 | 6.0×10-9 |
| H2SO3 | 1.5×10-2 | 1.0×10-7 |
☚ 酸、碱、盐的电离 电离度 ☛
- 财政拖累是什么意思
- 财政拨款是什么意思
- 财政拨款是什么意思
- 财政拨款是什么意思
- 财政援助是什么意思
- 财政支农周转金占用费管理试行办法是什么意思
- 财政支农资金是什么意思
- 财政支出是什么意思
- 财政支出是什么意思
- 财政支出是什么意思
- 财政支出是什么意思
- 财政支出是什么意思
- 财政支出是什么意思
- 财政支出是什么意思
- 财政支出与农业是什么意思
- 财政支出与国民储蓄是什么意思
- 财政支出原则是什么意思
- 财政支出可以从多种角度分类是什么意思
- 财政支出增长的宏观经济模型是什么意思
- 财政支出增长的微观经济模型是什么意思
- 财政支出增长的政治模型是什么意思
- 财政支出增长的经验分析模型是什么意思
- 财政支出形式是什么意思
- 财政支出效果是什么意思
- 财政支出的数量界限是什么意思
- 财政支出结构是什么意思
- 财政支出预测是什么意思
- 财政支持是什么意思
- 财政收入是什么意思
- 财政收入是什么意思
- 财政收入是什么意思
- 财政收入是什么意思
- 财政收入是什么意思
- 财政收入是什么意思
- 财政收入是什么意思
- 财政收入是什么意思
- 财政收入与农业是什么意思
- 财政收入与经济同步增长是什么意思
- 财政收入与财政支出是什么意思
- 财政收入内容是什么意思
- 财政收入原则是什么意思
- 财政收入可行数量界限是什么意思
- 财政收入客观数量界限是什么意思
- 财政收入形式是什么意思
- 财政收入总量变化分析是什么意思
- 财政收入最大数量界限是什么意思
- 财政收入来源是什么意思
- 财政收入真实性是什么意思
- 财政收入税收率是什么意思
- 财政收入结构是什么意思
- 财政收入结构变化分析是什么意思
- 财政收入结构变化分析是什么意思
- 财政收支是什么意思
- 财政收支内部控制制度审计是什么意思
- 财政收支审计是什么意思
- 财政收支平衡是什么意思
- 财政收支平衡是什么意思
- 财政收支平衡与物价是什么意思
- 财政收支矛盾与平衡转化问题是什么意思
- 财政收支统计是什么意思