延伸作用
延伸作用
在蛋白质生物合成中,70s或80s起始复合体一旦形成,延伸作用就立即开始。延伸就是氨基酸按照mRNA碱基顺序的指令逐个地聚合成为蛋白质的过程,包括起始作用之后和终止作用之前之间的所有反应步骤。延伸步骤可示如图。图示是肽链N末端第2位氨基酸加到其P位含fMet-tRNAiMet的70s起始复合体,不过这也是任一其他位置上的氨基酸加到肽链上的情况,所以延伸作用是很多次这同一反应的重复。延伸第一步是氨基酰tRNA结合到核糖体上面空出的A位上,结合上去的氨基酸的种类由mRNA的密码子决定。对这一步反应,两种可溶性蛋白质因子,即EFTu和EFTs,以及GTP是必需的。第二步是肽键的形成;在P位的tRNA上的甲硫氨酸(图中是甲酰甲硫氨酸)或肽基转移到A位上的氨基酸的自由氨基; 由核糖体上肽基转移酶催化。在体外实验,该步反应无需可溶性因子,亦不必外加能量。最后一步反应,A位上的肽基tRNA和mRNA移位至P位上,原在P位上的已经脱去了氨基酸或肽基的空载tRNA也就脱下,同时空出了A位并呈现出新的一个密码子。这步移位作用要有另一种称为EFG的可溶性因子参与,也需要GTP。
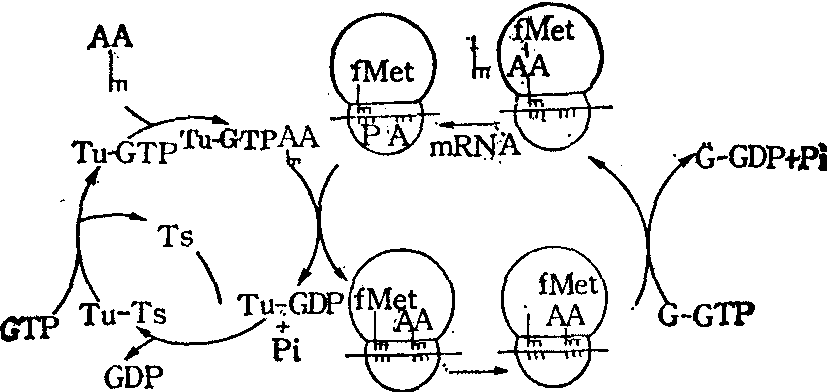
延伸步骤示意图
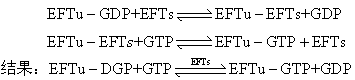
氨基酰tRNA结合到核糖体 1964年F. Lipmann实验室从大肠杆菌鉴定出延长因子T和G; 1966年该实验室从荧光假单胞菌(Pseudomonas fluorescens)分离出两个相互补充而发挥其EFT作用的成分,即目前称之为EFTs和EFTu的两种蛋白质因子。前者比较稳定; 在60℃下或较酸性的环境,EFTu均较EFTs先失活。在大肠杆菌中,EFTu和EFTs的含量相当丰富,两者共占细菌细胞质蛋白质总量达5%,提取纯化都还比较方便,已得到EFTu-GDP和EFTu-GTP结晶。通常分离出的EFTu含牢固结合的GDP;最初就发现纯化的因子的280nm/260nm吸光率比只有1.16这个异乎通常蛋白质所具有的1.65的值。后来证明分离得到的EFTu非共价结合一当量的二磷酸鸟苷。这一结合关系EFTu的活性;凡增加GDP解离速度的条件如低pH、低Mg2+、温度升高等等均可使这蛋白质因子失去活性;尽管GDP的加入可增加EFTu的稳定性,但仍比EFTs易失活。不同实验室不同方法所测得大肠杆菌EFTu分子量在42,000~46,000之间。其氨基酸组成分析未见不寻常之处; 含三个半胱氨酸残基,一是结合鸟苷酸所必需,又一是与AA-tRNA相互作用所必需。其N末端已封闭。大肠杆菌EFTs分子量约30,000,只含一个半胱氨酸残基,不含色氨酸; 在提取物中通常与EFTu缔合;此即当初发现的T因子。EFTu-EFTs稳定,经葡聚糖层析而很少解缔,但在大量GDP下解缔,即:

三元复合体AA-tRNA-EFTu-GTP是和核糖体相互作用的底物,作用的结果是把AA-tRNA转移到核糖体的A位上。要求的一个条件是核糖体P位上有肽基-tR-NA或fMet-tRNAfMet。伴同此反应的是GTP的水解,产生的EFTu-GDP就从核糖体上脱落。GTP的水解必须要求mRNA上密码子正确无误;如脯氨酰tRNAPro-EFTu-GTP复合体和含多聚胞苷酸的核糖体温育GTP就水解,若以多聚尿苷酸代替,却不被水解。由于EFTu-GDP不能与AA-tRNA反应,EFTu的再循环要和GTP结合。
以上为原核细胞的情况,在真核细胞则有叫做EF1的因子起相当于EFT的作用。在各种组织里,EF1以不同程度的聚集体形式存在,分子量从2×104至1×106。一些组织的EF1聚集体尚含脂类。高分子聚集体似较低分子者稳定。从很多种组织里纯化得到分子量约为50,000的蛋白质,可与GTP及AA-tRNA结合形成三元复合体,功能相当于大肠杆菌中的EFTu。多数实验室从聚集体中只得到这种50,000分子部分(称为EF1α),不过后来还从高分子聚集体中分离出另一蛋白质因子,称为EF1β。所有真核细胞或都含有这种因子,只是含量少,不易分离出。在变性条件下,EF1β 分子量27000,但天然条件下可能是一个二聚体; 它催化EF1α-GDP与GTP的交换及随后与AA-tRNA的结合,功能相当于EFTs。既然EF1α和EF1β似相当于EFTu和EFTs,它们最后促成AA-tRNA结合到核糖体上的反应也相类似。不过现已发现当AA-tRNA结合到核糖体后,IF1α仍滞留在核糖体上而没有立即脱落下。
肽键形成 肽键形成于核糖体上,通过把新生的肽链从肽基tRNA转移给氨基酰tRNA 上的自由α氨基而成;由于涉及基团转移,又称转肽基作用。在此过程中,肽基tRNA的酯键断开而合成一个新的肽键。除了核糖体及其所携带的合适底物外,这反应无需外加能源,亦不要可溶因子参加。携带着聚苯丙氨酰tRNA的70s核糖体,在确知可除去可溶因子条件下经过彻底洗过后,不必加入GTP,其聚苯丙氨酰基可与嘌呤霉素形成多聚苯丙氨酰嘌呤霉素。嘌呤霉素为氨基酰tRNA类似物,可结合到核糖体A位上并接受P位上肽基tRNA的肽基以形成肽键。上述事实证明催化转肽作用的酶存在于核糖体上。实际上聚苯丙氨酰tRNA-50s亚单位复合体就可促成聚苯丙氨酰嘌呤霉素的形成,表明转肽酶是50s亚单位的组成成分。显然,转肽酶包含催化中心以及分别和氨基酰tRNA与肽基tRNA 3′端(即-CCA-氨基酸与-CCA-肽基)结合的部位,可称之为A′位和P′位。亲和标记法(某些底物类似物或抗生素可结合到A′或P′位)显示A′位在L6、L15、L16和L18等蛋白质处,而P′位在L2、L11、L18、L20和L27处。亲和标记法检出转肽酶的组份(或邻近部位),可能包括本身与转肽酶无关的蛋白质,也可能漏检参与转肽酶活性作用的蛋白质。从功能上研究参与这反应的蛋白质的方法有一叫重组法的,是用盐处理除去50s亚单位的大部分蛋白质,剩下不具转肽酶活性的一个核心结构,然后逐个加回去分离出的蛋白质,观察何种蛋白质是活性所必需的,何种是非必需的。结果指示L2、L3、L15、L16和L18是必需的,而L4、L13、L17、L21、L25和L2的加入则可增大活性。其中L3、L17、L21和L25是未曾被亲和法所检查出的,而亲和法查出的L6和L11等在重组法中不是活性所必需。除了蛋白质之外,23s RNA也是活性所需,5sRNA也有增高活性作用。至于转肽作用机理,有酰基酶中间产物说,还有协同一步(Concerted)说,尚无定论。
☚ 肽链合成的起始 移位作用 ☛
- 慷慨爽快地答应是什么意思
- 慷慨的援助是什么意思
- 慷慨的王子是什么意思
- 慷慨直率是什么意思
- 慷慨直辞是什么意思
- 慷慨葛天歌,愔愔广陵陌。是什么意思
- 慷慨解囊是什么意思
- 慷慨解囊相赠是什么意思
- 慷慨语气是什么意思
- 慷慨赋诗还自恨,徘徊舒啸却生哀。是什么意思
- 慷慨赠人衣食是什么意思
- 慷慨赴义是什么意思
- 慷慨赴死易,从容就义难是什么意思
- 慷慨赴死易,从容就义难。是什么意思
- 慷慨输将是什么意思
- 慷慨辞朝阙,迢遥涉路尘。是什么意思
- 慷慨长歌是什么意思
- 慷慨陈义是什么意思
- 慷慨陈词是什么意思
- 慷慨陈辞是什么意思
- 慷慨须酬千载志,等闲莫负百年身。是什么意思
- 慷慨颇有余 锤炼憾不足——辛派词人的艺术是什么意思
- 慷慨馈赠是什么意思
- 慷慨,感慨是什么意思
- 慷爽是什么意思
- 慷直是什么意思
- 慷达是什么意思
- 慸是什么意思
- 慸葪是什么意思
- 慹是什么意思
- 慹服是什么意思
- 慺是什么意思
- 慺慺是什么意思
- 慺诚是什么意思
- 慻是什么意思
- 慼是什么意思
- 慼郎耽夙爱是什么意思
- 慽是什么意思
- 慾是什么意思
- 慾界是什么意思
- 慿是什么意思
- 憀是什么意思
- 憀亮是什么意思
- 憀亮聊亮是什么意思
- 憀悢是什么意思
- 憀慄是什么意思
- 憀憀是什么意思
- 憀戾是什么意思
- 憀栗是什么意思
- 憀栗凄如是什么意思
- 憁是什么意思
- 憁恫是什么意思
- 憂是什么意思
- 憂傷是什么意思
- 憂喜聚門是什么意思
- 憂心是什么意思
- 憂思是什么意思
- 憂懼是什么意思
- 憃是什么意思
- 憃头是什么意思