化学平衡的普遍性
化学平衡的普遍性huaxue pingheng de pubianx-ing
因在等温等压下,化学反应总是自动地向着自由焓减少的状态变化。一旦生成产物,则产物与反应物混合,必然存在混合熵。经热力学证明,其混合熵△Smix是大于零的。由
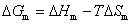
可知,由于混合熵的存在将导致反应体系的自由焓进一步降低。当体系的自由焓降至最小值时,则反应达到了平衡。例如气相反应
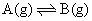
设温度T和总压p一定时,最初只有1molA,反应过程中A和B的物质的量的总数nA+nB始终为1,这时体系自由焓的变化如下图所示。
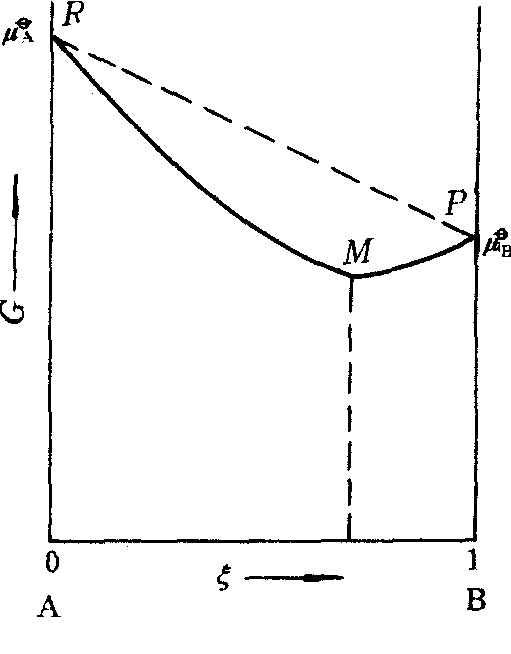

图中虚线RP为反应物A和产物B未混合反应过程中体系自由焓的变化; R点为反应前纯反应物的自由焓; P点为反应物全部转变为产物时纯产物的自由焓; 曲线RMP为A和B混合反应过程体系自由焓的变化,其中最低点M所对应的G值就是体系处于化学平衡时的自由焓,显然M点低于P点。由于反应过程产物与反应物不可能分离,使得体系的自由焓比纯产物的更低,根据自由焓判据,可逆反应是不能进行到底的。
☚ 反应摩尔自由焓 化学平衡定律 ☛
- 勿着牢刀是什么意思
- 勿着落是什么意思
- 勿矜朱门是,陋此白屋非。是什么意思
- 勿矜罗弋巧,鸾鹤在冥冥。是什么意思
- 勿知浆是什么意思
- 勿矫矫于浮云是什么意思
- 勿矫矫于浮云,勿逐逐于世网是什么意思
- 勿碌轴是什么意思
- 勿碍是什么意思
- 勿称心是什么意思
- 勿窝心是什么意思
- 勿笑(打《北史》人名一)莫胡芦是什么意思
- 勿算数是什么意思
- 勿管是什么意思
- 勿管帐是什么意思
- 勿管那哈是什么意思
- 勿紐于是什么意思
- 勿经是什么意思
- 勿经心是什么意思
- 勿罔是什么意思
- 勿罢是什么意思
- 勿翁是什么意思
- 勿翦是什么意思
- 勿考老是什么意思
- 勿肯是什么意思
- 勿能是什么意思
- 勿脚工夫是什么意思
- 勿自弃轩是什么意思
- 勿自弃轩遗稿是什么意思
- 勿自暴自弃是什么意思
- 勿舒齐是什么意思
- 勿色头是什么意思
- 勿色骰是什么意思
- 勿药是什么意思
- 勿药之喜是什么意思
- 勿药元诠是什么意思
- 勿药元铨是什么意思
- 勿药单方是什么意思
- 勿药有喜是什么意思
- 勿药病已是什么意思
- 勿药须知是什么意思
- 勿莫是什么意思
- 勿菴学派是什么意思
- 勿落是什么意思
- 勿落井下石是什么意思
- 勿落寣是什么意思
- 勿落局是什么意思
- 勿落槛是什么意思
- 勿落生是什么意思
- 勿落窠是什么意思
- 勿落路是什么意思
- 勿虑是什么意思
- 勿行是什么意思
- 勿要是什么意思
- 勿见乖是什么意思
- 勿见忒是什么意思
- 勿见脱是什么意思
- 勿角自然保护区是什么意思
- 勿言一樽酒,明日难重持是什么意思
- 勿言一樽酒,明日难重持。是什么意思