化学反应速率的计算
化学反应速率的计算huaxue fanying sulu de jis-uan
化学反应速率指单位时间内某一反应物或生成物的浓度变化,用以比较反应的快慢。若以Δc表示浓度变化,Δt表示反应时间间隔,则反应速率:
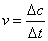
单位为mol·L-1·S-1或mol·L-1·min-1等。

由上可见:
❶ 无论用反应物还是用生成物浓度变化来表示,反应速率总取正值,不取负值。
❷化学反应速率随反应的进行而逐渐减漫。因此,时间间隔表示平均速率,若时间间隔越短,则越能表示瞬时速率。
❸ 以不同物质作标准表示反应速率时(如标明ν(O2),ν(SO2)等),其数值各不相同,但它们都表明是同一反应同一时间间隔的反应速率。
❹在化学反应中从各物质的变化表示的反应速率之比,等于反应方程中各系数(化学计量数)之比。如上述反应:
ν(SO2):ν(O2):ν(SO3)=0.15:0.075:0.15
=2: 1:2为此,只要求出以 一种物质表示的反应速率,便可推算以其他各物质表示的反应速率。
例2 在3L密闭容器内进行氮气和氢气合成氨反应,测得反应开始后2min氨为9mol,求这段时间内的反应速率。

答 反应速率 ν(N2)为0.75mol·L-1·min-1;ν(H2)为2.25mol·L-1·min-1;ν(NH3)为1.5mol·L-1·min-1。
例3 Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O的反应,在其他条件不变时,每升高10℃,反应速率增大到原来的2倍,现由20℃增加到50℃,反应速率将增大到原来的几倍?
分析 因为每升高10℃,反应速率为原来的2倍,现升高50-20=30 (℃),相当于增加3个“10℃的梯度”。
设20℃时反应速率为v,则
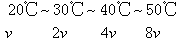
解 50-20=30(℃),30℃÷10℃=3,23=8答 反应速率增大到原来的8倍。
例4 将等摩尔的氢气和碘蒸气放入密闭容器中进行下列反应:
H2+I2(g)![]() 2HI,反应进行了2min,测得反应速率v(HI)=0.1mol·L-1·min-1,碘蒸气浓度为 0.4mol·L-1。求:
2HI,反应进行了2min,测得反应速率v(HI)=0.1mol·L-1·min-1,碘蒸气浓度为 0.4mol·L-1。求:
❶ 反应速度 v(H2),v(I2);
❷H2和I2的起始浓度;
❸2min末时HI的浓度。
提示 变化浓度=反应速率×变化时间。
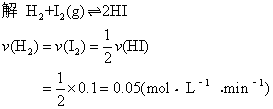
[H2]=[I2]=0.4+0.05×2=0.5(mol·L-1)〔HI〕=0.1×2-0=0.2(mol·L-1)
答 氢气和碘蒸气的反应速率均为0.05mol·L-1·min-1; 起始浓度均为0.5mol·L-1; 2min末碘化氢的浓度为0.2mol·L-1。
☚ 混合物反应的计算 化学平衡常数的计算 ☛
- 田输是什么意思
- 田辛是什么意思
- 田辛甫是什么意思
- 田辟疆是什么意思
- 田辰是什么意思
- 田農是什么意思
- 田边是什么意思
- 田边上用石块垒起来挡土的墙是什么意思
- 田边元是什么意思
- 田边元,t.是什么意思
- 田边地角的小块土地是什么意思
- 田边菊是什么意思
- 田辽山崖洞葬是什么意思
- 田迁是什么意思
- 田连仟伯是什么意思
- 田连仟佰是什么意思
- 田连元是什么意思
- 田连阡陌是什么意思
- 田连阡陌,家累千金是什么意思
- 田连阡陌;家累千金是什么意思
- 田述古是什么意思
- 田逸民是什么意思
- 田遂是什么意思
- 田道生是什么意思
- 田遨是什么意思
- 田邑是什么意思
- 田邦璇是什么意思
- 田邻侵界案是什么意思
- 田郎字是什么意思
- 田 部是什么意思
- 田部是什么意思
- 田部吏是什么意思
- 田采堂是什么意思
- 田里是什么意思
- 田里不装水——有漏(路)子是什么意思
- 田里不鬻是什么意思
- 田里中田是什么意思
- 田里滚,地里爬是什么意思
- 田里的庄稼是什么意思
- 田里的杂草是什么意思
- 田里的泥鳅——滑头滑脑是什么意思
- 田里的甘蔗是什么意思
- 田里的秧鸡儿——顾头不顾尾是什么意思
- 田里的秧鸡儿顾头不顾尾是什么意思
- 田里的蚯蚓是什么意思
- 田里的蚯蚓——满肚疑(泥)是什么意思
- 田里相安,裤襦歌了,却来持橐。是什么意思
- 田里,能长谷子,也能长荒草是什么意思
- 田重进是什么意思
- 田野是什么意思
- 田野上残存的花朵是什么意思
- 田野下俚是什么意思
- 田野与都邑是什么意思
- 田野中自然形成的或人工修筑的像台阶形状的东西是什么意思
- 田野农业是什么意思
- 田野卷耳是什么意思
- 田野又是青纱帐是什么意思
- 田野四周是什么意思
- 田野地役权是什么意思
- 田野扫雷是什么意思