亚硝酸
亚硝酸yaxiaosuan
化学式HNO2,是氮 (+Ⅲ) 的含氧酸,酸酐为三氧化二氮N2O3。亚硝酸是一弱酸,酸性比醋酸稍强 (Ka=5×10-4),仅存在于稀的水溶液中,极不稳定,加热即歧化分解:
3HNO2=HNO3+2NO+H2O
亚硝酸既有氧化性,又有还原性。由电极电势可知,酸性介质中亚硝酸的氧化性比还原性强。例如,它能将I-氧化成碘:
2HNO2+2I-+2H+=I2+2NO+2H2O
此反应可用于分析测定。通常亚硝酸被还原成一氧化氮,但也可被还原成氧化二氮、氮、胲或氨。它被氧化时,成为硝酸。亚硝酸与氨可发生下列反应:HNO2+NH3=N2+2H2O
实验室中用亚硝酸钠固体与氯化铵溶液作用制备氮气,根据这一反应原理,还可用铵盐来消除溶液中的NO-2。亚硝酸结构有顺、反两种形式。一般反式比顺式稳定。NO-2中的氮氧上都有孤电子对,是异性双位配体可和许多过渡金属离子形成配离子,常见的有[Co(NH3)5NO2]2+,[Co(NO2)6]3-等。将强酸加到冷冻的亚硝酸盐溶液中,可制得亚硝酸溶液,如:
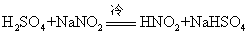
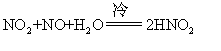
☚ 硝酸盐 亚硝酸盐 ☛
亚硝酸
nitrous acid
- 罗屏是什么意思
- 罗屏汉是什么意思
- 罗履先是什么意思
- 罗山是什么意思
- 罗山县(城关镇)是什么意思
- 罗山国家森林公园是什么意思
- 罗山天湖战国墓是什么意思
- 罗山记是什么意思
- 罗山遗书是什么意思
- 罗岕茶记是什么意思
- 罗岗香雪从何来是什么意思
- 罗岳氏是什么意思
- 罗峙是什么意思
- 罗峪新桥是什么意思
- 罗峪村是什么意思
- 罗峪沟泥石流是什么意思
- 罗峪河是什么意思
- 罗峪河南桥是什么意思
- 罗峪河堤是什么意思
- 罗峪河桥是什么意思
- 罗峰是什么意思
- 罗崇福是什么意思
- 罗川之战是什么意思
- 罗川县是什么意思
- 罗川古城是什么意思
- 罗川文庙大殿是什么意思
- 罗川石坊是什么意思
- 罗州是什么意思
- 罗工柳是什么意思
- 罗巧福是什么意思
- 罗差是什么意思
- 罗巴切夫斯基是什么意思
- 罗巴切夫斯基几何是什么意思
- 罗巴切夫斯基函数是什么意思
- 罗巴切夫斯基平行公理及推论是什么意思
- 罗巴场是什么意思
- 罗巴茨,j. p.是什么意思
- 罗巾是什么意思
- 罗巾今在手,日得随妾身。是什么意思
- 罗布是什么意思
- 罗布增苏勒和木是什么意思
- 罗布天空定时出现的恒星是什么意思
- 罗布尔是什么意思
- 罗布尔杜是什么意思
- 罗布希是什么意思
- 罗布庄是什么意思
- 罗布手巾是什么意思
- 罗布札是什么意思
- 罗布村的情祭是什么意思
- 罗布林是什么意思
- 罗布林卡是什么意思
- 罗布林,d.是什么意思
- 罗布林,r.p.是什么意思
- 罗布桑是什么意思
- 罗布桑却丹是什么意思
- 罗布桑嘉措是什么意思
- 罗布桑巴尔丹是什么意思
- 罗布桑巴尔丹吉格梅特是什么意思
- 罗布桑旺札勒是什么意思
- 罗布桑朱力特木是什么意思