不同浓度酸或碱混合后的pH值计算
不同浓度酸或碱混合后的pH值计算butongnongdu suan hou jian hunhehou de pHzhi jis-uan
不同浓度同种酸或碱混合时,一般因浓度较小时,混合液的体积可认为是混合前各溶液体积之和(如果给出溶液密度,则应通过密度求混合液之体积)。溶质的量是各溶液溶质量的总和,算出混合液的H+浓度,即可算其pH值。强电解质溶液混合时,可直接计算其H+浓度。弱电解质溶液混合时必须考虑浓度变化对电离平衡的影响,用电离常数、电离度和浓度来计算H+,然后求pH值。
例1 10mL pH1=2的盐酸溶液与20mL pH2=3的盐酸溶液混合,求混合液的pH3值。解 盐酸为强电解质,pH1=2,所以
〔H+〕1=0.01mol·L-1;
pH2=3,〔H+〕2=0.001mol·L-1混合后:
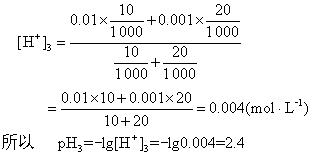
答 混合液的pH为2.4。
例2 pH1=12和pH2=10的氢氧化钠溶液各100mL混合,求混合液的pH3值。
解 NaOH为强电解质在水中100%电离

答 混合液的pH为11.7。
例3 0.1mol·L-1醋酸溶液100mL与0.01mol·L-1醋酸溶液200mL相混合,求混合液的pH值(已知醋酸的电离常数为1.8×10-5)。
解 混合液的浓度
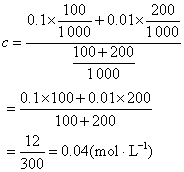
平衡时H+浓度为x,根据方程:
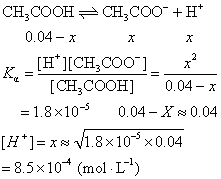
pH=-1g〔H+〕 =-1g8.5×10-4=3.07
答 混合液的pH为3.07。
☚ 溶液稀释后的pH值计算 酸与碱混合后溶液的pH值计算 ☛
- 史道邻是什么意思
- 史邦俊是什么意思
- 史部是什么意思
- 史部要籍解题是什么意思
- 史都蒙是什么意思
- 史都蒙奉使日本是什么意思
- 史里芬是什么意思
- 史里芬计划是什么意思
- 史量才是什么意思
- 史量才事件是什么意思
- 史量才收购《新闻报》受挫是什么意思
- 史量才被刺是什么意思
- 史量才遇刺身亡是什么意思
- 史量才遇难案是什么意思
- 史鉴是什么意思
- 史鉴宗是什么意思
- 史鉴录.北宋~元是什么意思
- 史鉴录.夏~西汉是什么意思
- 史鉴录.新~南北朝是什么意思
- 史鉴录.明~清是什么意思
- 史鉴录.隋~五代十国是什么意思
- 史鉴铭是什么意思
- 史鑑铭是什么意思
- 史鑒銘是什么意思
- 史钞是什么意思
- 史钦琛是什么意思
- 史钧杰是什么意思
- 史铁生是什么意思
- 史铁生《合欢树》是什么意思
- 史铁生《合欢树》赏析是什么意思
- 史铁生 我的遥远的清平湾是什么意思
- 史锁洪是什么意思
- 史锡五是什么意思
- 史锡尧是什么意思
- 史镜是什么意思
- 史长才是什么意思
- 史阙文是什么意思
- 史阙疑是什么意思
- 史阙疑的故事是什么意思
- 史阿是什么意思
- 史陵是什么意思
- 史隆甫是什么意思
- 史隽之是什么意思
- 史集是什么意思
- 史集之是什么意思
- 史雪松是什么意思
- 史雪汀是什么意思
- 史霄雯是什么意思
- 史震己是什么意思
- 史震林是什么意思
- 史青是什么意思
- 史青云是什么意思
- 史韵是什么意思
- 史頌𣪕是什么意思
- 史顯簠是什么意思
- 史颖是什么意思
- 史风正是什么意思
- 史館是什么意思
- 史館稿傅是什么意思
- 史馆是什么意思