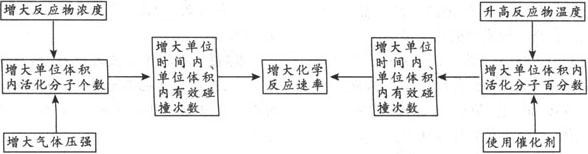
注意 1.稀有气体对反应速率的影响:
❶ 若容器恒温、恒容,则充入的稀有气体(或其他不反应的气体)虽改变了容器内气体压强,但没有改变反应物的浓度,不影响反应速率.
❷ 若容器恒温、恒压,则充入的稀有气体(或其他不反应的气体),虽未减少容器内的压强,但却减小了反应产生的分压,即降低了反应物的浓度,所以反应速率降低.
2.外界条件的变化对v正、v逆的影响:
❶ 温度:升温,v正、v逆一般均增大,吸热反应增大的倍数大于放热反应增大的倍数;降温则相反.
❷ 压强:加压,对有气体参加的反应,v正、v逆均增大,气体体积之和大的一侧增加的倍数大于气体体积之和小的一侧增加的倍数;减压则相反.
❸ 浓度:增加反应物的浓度,v正急剧增大,而后逐渐减小,最终比增加浓度之前大;v逆逐渐增大直至与变化的v正相等.
❹ 催化剂:加催化剂,使v正、v逆同时增大,且程度相同.
例 (1997·上海·8)设C+CO2 2CO;△H>0,反应速率v1;N2+3H2
2CO;△H>0,反应速率v1;N2+3H2 2NH3;△H<0,反应速率为v2.对于上述反应,当温度升高时,v1和v2的变化情况为( ).
2NH3;△H<0,反应速率为v2.对于上述反应,当温度升高时,v1和v2的变化情况为( ).
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大
解析 温度升高,反应速率都增大.对于一个可逆反应来说,吸热反应速率增大的倍数比放热反应增大的倍数要大.
答 A.
- 刻诛是什么意思
- 刻谿是什么意思
- 刻谿刻峭是什么意思
- 刻财棍是什么意思
- 刻责是什么意思
- 刻贼是什么意思
- 刻赤是什么意思
- 刻赤之战是什么意思
- 刻足以适屦是什么意思
- 刻足适屦是什么意思
- 刻蹭是什么意思
- 刻轹是什么意思
- 刻辞是什么意思
- 刻边款是什么意思
- 刻酷是什么意思
- 刻銘陶盉是什么意思
- 刻鏤是什么意思
- 刻铜匠是什么意思
- 刻铭是什么意思
- 刻铭砖是什么意思
- 刻铭铜甗是什么意思
- 刻铭铜镜是什么意思
- 刻铭银壶是什么意思
- 刻铭陶盉是什么意思
- 刻镂是什么意思
- 刻镂的样子是什么意思
- 刻限是什么意思
- 刻陗是什么意思
- 刻雕是什么意思
- 刻雾裁风是什么意思
- 刻露是什么意思
- 刻面是什么意思
- 刻顷是什么意思
- 刻飾是什么意思
- 刻饰是什么意思
- 刻骨是什么意思
- 刻骨之恨是什么意思
- 刻骨仇恨是什么意思
- 刻骨入微是什么意思
- 刻骨刺心是什么意思
- 刻骨刻肌是什么意思
- 刻骨崩心是什么意思
- 刻骨洗髓是什么意思
- 刻骨相思是什么意思
- 刻骨相思入骨相思是什么意思
- 刻骨铭心是什么意思
- 刻骨铭心的思念之情是什么意思
- 刻骨铭肌是什么意思
- 刻骨镂心是什么意思
- 刻骨镌心是什么意思
- 刻鹄是什么意思
- 刻鹄不成是什么意思
- 刻鹄不成尚类鹜是什么意思
- 刻鹄不成尚类鹜……画虎不成反类狗。是什么意思
- 刻鹄成鹜是什么意思
- 刻鹄斋是什么意思
- 刻鹄斋丛书是什么意思
- 刻鹄类骛是什么意思
- 刻鹄类鹜是什么意思
- 刻鹄类鹜刻鹄不成是什么意思