阿伏伽德罗定律
阿伏伽德罗定律afujiadeluo dinglu
在相同的温度与压强下,任何气体相等容积所含的分子数(或摩尔数)相等。还可以表述为:在相同的温度与压强下,1摩尔任何气体所占的容积都相等。阿伏伽德罗定律是由意大利科学家阿伏伽德罗在解释气体进行化学反应时参加反应气体体积之间的相互关系时,于1811年以假说的形式提出来的,由于当时科学界还不能区分分子和原子,尚不能解释有些分子发生离解的情况,从而未被公认。直到1860年这一假说才被普遍承认,称为阿伏伽德罗定律。阿伏伽德罗定律对科学的发展,特别是对原子量的测定起了重大的推动作用。根据该定律还可以求出分子物理的几个重要常数,在标准状态下,由理想气体的压强公式,可得

NA=n0V0=2.686754×10
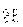 5×22.41383×10-36.022045×1023(摩尔-1)
5×22.41383×10-36.022045×1023(摩尔-1)NA称为阿伏伽德罗常量。阿伏伽德罗定律不仅适用于由分子、原子组成的物质系统,也可以是由离子、电子以及其他粒子或这些粒子的特定组合所组成的系统,因此阿伏伽德罗定律可以推广为:1摩尔任何物质所包含的基本单元数都等于阿伏伽德罗常量。
☚ 盖·吕萨克定律 态参量 ☛
阿伏伽德罗定律
Avogadro's law
阿伏伽德罗定律
Avogadro's law
- 谢绍曾是什么意思
- 谢绛是什么意思
- 谢绛《游嵩山寄梅殿丞书》是什么意思
- 谢绝是什么意思
- 谢绝交往是什么意思
- 谢绝交游,不问世事是什么意思
- 谢绝会客是什么意思
- 谢绝医疗是什么意思
- 谢绝外客(打五言唐诗一句)人生不相见是什么意思
- 谢绝宾客是什么意思
- 谢绝对方的客气话是什么意思
- 谢绝应酬,不与亲友往来是什么意思
- 谢绝援助是什么意思
- 谢绝来客的婉辞是什么意思
- 谢绝来访是什么意思
- 谢绝礼金是什么意思
- 谢绝第三次执政传统是什么意思
- 谢绝邀请是什么意思
- 谢继书是什么意思
- 谢继出是什么意思
- 谢继友是什么意思
- 谢继祥是什么意思
- 谢继良是什么意思
- 谢继鸿是什么意思
- 谢绳武是什么意思
- 谢维俊是什么意思
- 谢维周是什么意思
- 谢维屏是什么意思
- 谢维扬是什么意思
- 谢维梁人是什么意思
- 谢维甸是什么意思
- 谢维藩是什么意思
- 谢缄是什么意思
- 谢缙是什么意思
- 谢缙孙是什么意思
- 谢缙少陵诗意图轴是什么意思
- 谢缙的传说是什么意思
- 谢缵泰是什么意思
- 谢罗是什么意思
- 谢罗夫是什么意思
- 谢罗山是什么意思
- 谢罪是什么意思
- 谢罪广告是什么意思
- 谢美惠是什么意思
- 谢群芳是什么意思
- 谢群英是什么意思
- 谢翊元是什么意思
- 谢翔是什么意思
- 谢翔宝是什么意思
- 谢翠霞是什么意思
- 谢翥是什么意思
- 谢翰周是什么意思
- 谢翰文是什么意思
- 谢翱是什么意思
- 谢翱《书文山卷后》是什么意思
- 谢翱《小炉峰三瀑记》是什么意思
- 谢翱《月泉游记》是什么意思
- 谢翱《登西台恸哭记》是什么意思
- 谢翱《秋夜词》是什么意思
- 谢翱《西台哭所思》是什么意思