金属与盐溶液间的置换反应
金属与盐溶液间的置换反应jinshu yu yanrongyiejiande zhihuan fanying
属于原子与离子之间的氧化-还原反应。反应规律:
❶ 较活泼的金属还原性强,较不活泼金属的阳离子氧化性强,故较活泼的金属置换较不活泼的金属。
❷ 盐类必须溶于水才能电离出离子,故只有可溶性盐的水溶液才会与金属反应。常见反应有:
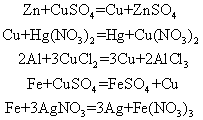
极活泼的金属 (钾、钠、钡、钙等) 常温下与水剧烈反应,因此它们不能置换出盐溶液中的金属。例如,钠与硫酸铜溶液反应时,钠首先与水反应生成氢气和氢氧化钠,氢氧化钠又与硫酸铜发生复分解反应:
2Na+2H2O+CuSO4=Na2SO4+Cu (OH)2↓+H2↑
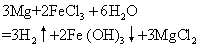
此外,当两种金属的活泼性相近时,较不活泼的金属可把较活泼的金属从它的浓盐溶液中置换出来。例如,锡、铅的活泼性很相近,通常情况下的置换关系:
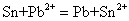
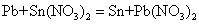
☚ 金属与酸之间的置换反应 非金属间的置换反应 ☛
- 22.青海省虹鳟鱼的引种及养殖示范研究是什么意思
- 230是什么意思
- 2300、2800×p矿用挖掘机电机电控是什么意思
- 230年是什么意思
- 230年~242年是什么意思
- 2311【见兔顾犬】是什么意思
- 2312【见物不见人】是什么意思
- 2313【遗臭万年】是什么意思
- 2314【斐然成章】是什么意思
- 2315【出乖露丑】是什么意思
- 23. 1979—1982年世界性经济危机的原因与性质是什么意思
- 231k【肉食者鄙】是什么意思
- 231m【光彩夺目】是什么意思
- 231s【遇人不淑】是什么意思
- 231x【常备不懈】是什么意思
- 231y【光风霁月】是什么意思
- 231年是什么意思
- 2323【光复旧物】是什么意思
- 232r【同心同德】是什么意思
- 2331【出生入死】是什么意思
- 2332【步人后尘】是什么意思
- 2333【黯然失色】是什么意思
- 2334【畅所欲言】是什么意思
- 233r【黑白分明】是什么意思
- 234是什么意思
- 2342【助桀为虐】是什么意思
- 2343【出人意外】是什么意思
- 2344【罪魁祸首】是什么意思
- 234k【内外交困】是什么意思
- 234t【出人头地】是什么意思
- 234年是什么意思
- 235是什么意思
- 2354【见义勇为】是什么意思
- 2355【同心戮力】是什么意思
- 235m【助我张目】是什么意思
- 235地质队卫生所是什么意思
- 235年是什么意思
- 236年是什么意思
- 237年是什么意思
- 23b1 【餐风宿露】是什么意思
- 23c6【同条共贯】是什么意思
- 23cs【同舟共济】是什么意思
- 23h1【中饱私囊】是什么意思
- 23hs【愚公移山】是什么意思
- 23n2【果然如此】是什么意思
- 23r2【出手得卢】是什么意思
- 23r3【见风使舵】是什么意思
- 23rz【归心似箭】是什么意思
- 23s3【逍遥法外】是什么意思
- 23s4【尘饭涂羮】是什么意思
- 23t3【见危授命】是什么意思
- 23xm【赏心悦目】是什么意思
- 23yg【见多识广】是什么意思
- 23. 中国民族资本主义工业“黄金时代”的时间是什么意思
- 23. 乡镇企业的地位是什么意思
- 23. 供销合作社的性质是什么意思
- 23.兰州市园林科学研究所是什么意思
- 23. 关于“劳”的范围是什么意思
- 2.3 典籍是什么意思
- 2.3 受精是什么意思