蔬菜组织培养tissue culture of vegetable
在无菌条件下,采用人工培养基离体培养蔬菜作物的器官、组织、细胞或原生质体,利用植物细胞全能性,促使其分裂分化或诱导成苗的技术。它对改进育种手段和方法,提高育种效率;创造新的育种材料,保存某些特殊的种质资源;培育脱毒无性系;发展快繁技术等都有重要意义。蔬菜组织培养主要包括胚胎培养、器官培养、愈伤组织培养、细胞培养和原生质体培养。
植物组织培养的探索和研究始于20世纪初,曾使用多种蔬菜作物作为试验材料。1904年汉宁(Hanning)离体培养萝卜和辣根的胚,发现离体胚可以充分发育并可提前萌发形成小苗,这是世界上胚胎培养最早的成功实例。1934年美国人怀特 (P. R. White) 用番茄根尖培养,获得了第一个活跃生长的无性繁殖系,50年代用胡萝卜根外植体愈伤组织进行液体培养,继代成功,并诱导分化出完整植株。蔬菜组织培养的这一系列突破性成就,在植物组织培养史上占有重要地位。培养方法,特别是培养基的重大改进促进了组织培养的发展和提高,例如,腺嘌呤作用的研究及其与生长素配比的试验,明确了控制芽和根分化的主要条件; 激动素代替腺嘌呤促进成芽后,其效果明显提高。随着植物组织培养研究的深入开展,有关的理论学说逐步形成。1943年怀特提出植物细胞全能性的学说,其后,斯科格(F.Skoog)和中国学者崔澂建立起器官形成的概念。60年代以来,蔬菜组织培养进入迅速发展阶段,技术日趋完善,开始进入实用阶段,取得一系列重大成就。中国马铃薯脱毒无性系的推广应用面积,已达该作物总栽培面积的50~60%。商业化草莓组培脱毒技术的应用,已使许多国家的草莓单位面积产量和质量明显提高。甜椒等蔬菜作物的花药培养与常规育种方法的结合,加快了纯系的选择。此外,细胞突变体筛选等技术已用于抗病、抗盐、抗除草剂新品种的选育。组织培养技术和分子遗传学、分子生物学等学科的渗透和融合,展示了生物工程的巨大潜力和广阔的发展前景,受到世界各国的重视。
蔬菜作物的胚胎培养 主要包括试管受精、子房培养、胚珠培养、胚胎培养和胚乳培养。
试管受精是指在离体条件下实现植物的受精作用。用以克服远缘杂交可能出现的受精障碍和由于雄蕊和柱头的选择作用形成的自交不亲和现象。这一技术最初是将花粉送入子房,花粉萌发后将精子送入胚珠,完成受精。现在已经发展到将胚珠从子房内取出放在试管内培养,在胚珠外加一些促进花粉萌发的物质,然后把无菌花粉或已萌动的花粉撒在胚珠上,完成正常的受精过程,产生种子。试管受精时应注意花粉及胚珠发育时期的选择和不同阶段适宜培养基的选配以及培养条件的控制。
子房培养分为未授粉子房和授粉后子房的离体培养。未授粉子房培养的诱导率与胚囊的发育时期有关,一般选用开花前1~5天的子房进行离体培养为适宜。经培养后,卵细胞、助细胞、反足细胞均可起动产生具2个细胞的原胚细胞。由原胚细胞继续分裂形成胚状体或愈伤组织再诱导成单倍体植株。用这种方法,洋葱、白菜等已获成功。授粉子房的离体培养多用于远缘杂交后促使种子成熟的辅助培养,在芸薹属植物培养中一般用MS或B5基本培养基诱导杂种胚的形成率较高。
胚珠培养利于体积极小的胚和种间杂种胚的萌发。随着胚珠生长发育天数的增加,培养条件可逐步简化,成活率可逐渐增加。胚珠培养时,胎座组织的存在对胚的生长起着重要的促进作用。
胚胎培养可分为幼胚培养和成熟胚培养。胚越小,所需的营养物质越复杂,除无机盐外,必须加入氨基酸、维生素、植物激素和天然提取物; 比较大的胚只需无机盐和蔗糖等物质。胚培养的萌发形式主要有:与正常胚相似的胚性萌发; 培养后不经胚性生长的早熟萌发; 或经愈伤组织分化胚状体或不定芽。胚培养技术已成功地用于白菜、结球甘蓝、南瓜、番茄等作物,解决了种间杂种幼胚中途败育的问题。
胚乳培养可获得三倍体植株。胚乳的发育类型及生长发育程度(早期、旺盛生长期、成熟期)直接影响胚乳外植体愈伤组织的生长和诱导频率的高低。一般认为,在胚乳旺盛期取材最合适。取材时还须避免胚乳以外组织或细胞的混入。
蔬菜作物的器官培养 主要包括根、茎、叶、花以及种子的离体培养。
茎的离体培养可用于蔬菜作物的脱毒、快速繁殖和突变芽的繁殖等,按取材的部位可分为茎尖培养和茎段或块茎培养。
茎尖培养的难易与取材大小有关,取材大小因培养目标而异。以快速繁殖为主要目标时,一般取材较大,诱导芽原基产生愈伤组织或直接分化形成丛生芽。脱毒培养取材较小,一般在0.1~0.5毫米之间,培养时成活率较低。为提高成活率,有人采用较大茎尖,辅以热处理和抗毒剂,也取得一定效果。
用茎段和块茎培养时,具有芽的材料多数由芽萌发诱导成苗,虽然成苗迅速,但成苗率低,有时也可从芽眼处诱导丛生芽或苗; 不具芽的茎段或块茎,多数经愈伤组织或不定芽诱导成苗,少数由切块表面细胞直接分裂产生胚状体,诱导成苗。
叶的离体培养多用于快速繁殖,已在番茄、结球甘蓝、辣椒、黄花菜、大蒜等蔬菜作物上取得成功。以叶片切块为材料进行培养,一般具有较强的再生能力,诱导形成植株的过程大致如下:
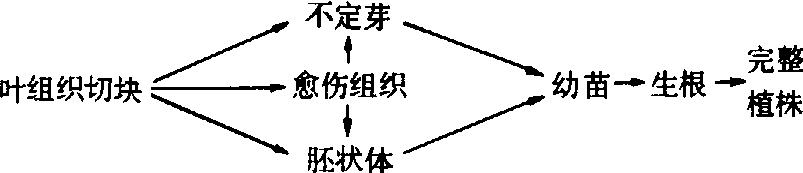
根的离体培养一般用于生理研究。此项技术研究较早,已先后在番茄、马铃薯、萝卜、胡萝卜、芥菜、豌豆、百合等多种蔬菜作物上获得成功。
花器的离体培养包括花药培养和花托等其他花器官的培养。花药培养是诱导单倍体植株、改进育种方法的重要途径(见单倍体育种)。花茎、花托、花瓣等在适宜的培养基上培养时,多数首先形成愈伤组织,然后诱导成苗,其中以花茎和花托的诱导再生力较强。应用花器官诱导的植株,一般阶段发育提前。花椰菜、球茎甘蓝、羽衣甘蓝、芜菁、萝卜等均已培养成功。
种子的离体培养是指以种子或萌动种子的上胚轴、下胚轴、子叶等为材料进行培养,可加快植物体的繁殖速度,打破由于种皮或外界因素造成的休眠,提高小粒种子的萌发率。此法已在花椰菜、白菜、黄瓜、辣椒、结球甘蓝、黄花菜等作物上取得成功。
蔬菜作物的细胞培养 由于操作是在细胞水平上进行的,因而可以高度地利用空间和时间,便于调控。可用于细胞筛选和细胞遗传学的研究。常用的培养方式有:❶悬浮培养。将植物细胞和细胞聚集体悬浮在液体培养基中进行培养,经过愈伤组织的诱导和继代后,使单细胞从组织上分离,然后经过单细胞的收集再次进行悬浮培养,诱导细胞分裂成愈伤组织再生植株。番茄等蔬菜作物的细胞悬浮培养已获成功。
❷平板培养。操作时将单细胞悬浮液与30~35℃呈融化状态的琼脂均匀混合,然后倒入培养皿成一薄层,待琼脂冷却固化后,分布在其中的细胞可分裂、分化、生长。
❸微室培养。以三块盖玻璃用石蜡油按一定方式固定在载玻璃上形成小室并充入培养基进行细胞培养。
蔬菜作物的原生质体培养 20世纪60年代初,有人利用漆斑霉产生的纤维素酶粗制剂,从番茄根尖分离出原生质体,为原生质体培养和细胞融合提供了可能性。其后,日本科学家从根霉中提取果胶酶,从绿色木霉中提取纤维素复合酶,使原生质体的游离在许多作物上取得成功。70年代以来,经过各国科学家的努力,已从胡萝卜、马铃薯、黄瓜等蔬菜作物的原生质体诱导出植株。此外,在结球甘蓝和大白菜等的细胞融合的研究上有显著进展。
应用原生质体培养,可以研究植物细胞膜的结构与功能以及病毒侵染的方式,还可通过抗病脱氧核糖核酸(DNA)和游离固氮菌的转育,培育出新品种。
人工种子 是以组织培养获得的可以发育成完整个体的分生组织或胚为材料,用适当的方法加以包被而形成的可以代替植物种子进行繁衍传播的个体。位于人工种子核心部位的胚或分生组织体积极小,被封闭在直径仅数毫米的胶囊内。胶囊的内膜和外膜组成极薄的“种衣”,一般由生物降解物制成。膜内充满由一定比例和浓度的营养物质、生长激素(必要时加入杀虫剂、杀菌剂、除草剂、弱毒病毒等)构成的胶状体,相当于胚乳。
人工种子能够固定一代杂种的杂种优势,繁殖雄性不育系、自交不亲和系、雌性系等材料,并且可以繁殖远缘杂交、细胞融合、基因工程等获得的材料,从而使这些新的技术实用化。鉴于人工种子的上述特殊作用,许多国家的科学家正大力进行这一技术的研究,以期实现其实用化。80年代已研制成功人工种子的蔬菜有芹菜、叶用莴苣、花椰菜等。
- royo sanchez,aristides是什么意思
- roy,b. c.是什么意思
- roy,dhirananda是什么意思
- roy,dilip-kumar是什么意思
- roy,dwijendralal是什么意思
- roy,kshitis是什么意思
- roy,manabendra nath是什么意思
- roy,ram mohan是什么意思
- roy,rammohun是什么意思
- roy,satischandra是什么意思
- rp是什么意思
- rp/pr相关性是什么意思
- r.p.r. 保卫共和联盟是什么意思
- rpr试剂盒是什么意思
- r-p'间期是什么意思
- r r是什么意思
- rr是什么意思
- rr12【似是而非】是什么意思
- rr13【依依不舍】是什么意思
- rr1s【待价而沽】是什么意思
- rr1t【价值连城】是什么意思
- rr1y【侃侃而谈】是什么意思
- rr23【俯仰由人】是什么意思
- rr24【行行出状元】是什么意思
- rr31【例行公事】是什么意思
- rr44【倒行逆施】是什么意思
- rr4b【晓行夜宿】是什么意思
- rr4h【星星之火】是什么意思
- rr4m【俯仰之间】是什么意思
- rr4y【循循善诱】是什么意思
- rr6t【借题发挥】是什么意思
- rrcc【明日黄花】是什么意思
- r(ren)是什么意思
- rr lyrae stars是什么意思
- rrr3【假仁假义】是什么意思
- rrrb【衔华佩实】是什么意思
- rrss【影影绰绰】是什么意思
- rrt3【旷日持久】是什么意思
- rrxk【依依惜别】是什么意思
- rs是什么意思
- rs11【依流平进】是什么意思
- rs14【停滞不前】是什么意思
- rs31【作法自毙】是什么意思
- rs3s【倒海翻江】是什么意思
- rs4s【他山之石】是什么意思
- rs53【倒绷孩儿】是什么意思
- rs5s【暗礁险滩】是什么意思
- rsabha是什么意思
- rsabhadvipa是什么意思
- rsabhakuta是什么意思
- rsabhaparvata是什么意思
- rsabhatirtha是什么意思
- rsabha ⅰ是什么意思
- rsabha ⅱ是什么意思
- rsabha ⅲ是什么意思
- rsabha ⅳ是什么意思
- rsadha是什么意思
- rsfsr是什么意思
- rsi是什么意思
- rsigiri是什么意思