电解规律及溶液的pH值变化
电解规律及溶液的pH值变化dianjie guilu jirongye de pH zhi bianhua
在电解过程中电解质电离出的阴、阳离子和水电离出的H+,OH-均有可能在阴、阳两极放电。根据放电顺序,由于电解质的种类不同,因而电极产物也不同,同时电解质溶液在电解过程中的pH值变化也不同。本条目现从电解电解质溶液的规律及各规律中pH值的变化入手,通过实验,找出它们之间的规律:
❶ 电解无氧酸(HCl,HI,HBr)或电解不活泼金属无氧酸盐 如通过电解HCl或CuCl2的实验,在阴极分别得到H2,Cu,在阳极得到Cl2。在整个电解过程中,实际是电解质本身参与反应,而水在电解过程中不参与反应,所以电解HCl或CuCl2等于是电解电解质本身:
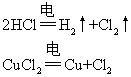
❷ 电解活泼金属的无氧酸盐或不活泼金属含氧酸盐。如通过电解CuSO4或电解NaCl溶液的实验,在阴极得到不活泼金属单质或氢气,在阳极得到氧气或卤单质。在整个过程中,电解电解质溶液,其电解质与水均参与了反应,实际上是电解质电离出的两种离子和水电离出的H+,H-比较,按其放电趋势的大小而放电:
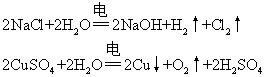
❸电解含氧酸、强碱、强酸强碱盐、活泼金属弱含氧酸盐 如通过电解H2SO4,NaOH,Na2SO4,Na2CO3等溶液,在阴、阳两极均得到H2和O2。实际上电解这4种盐的溶液是电解水,与电解质本身无关。由于是电解水,等于电解后的溶液溶剂减少,溶液的浓度增大: 电解含氧酸的pH值减小; 电解强碱溶液的pH值增大; 电解强碱强酸溶液的pH值不变; 电解强碱强酸酸式盐,pH值减小; 电解活泼金属弱含氧酸盐溶液pH值增大,溶剂减少,溶液浓度增大,水解增大。由弱酸含氧酸根所水解出的[OH-]增大,所以pH值增大。
综上所述,在电解电解质的溶液过程中,首先应分析电解质溶液中的4种离子,根据各种离子在阴、阳两极放电顺序:
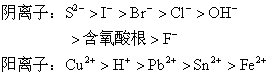
特别要注意H+,OH-的位置,从而写出有关放电过程。其次分析溶液的pH值,主要决定于[H+]及[OH-]。
☚ 硫元素价态变化的实验验证及变化规律 动物肝脏及血液中铁的含量 ☛
- 妞子是什么意思
- 妟是什么意思
- 妠是什么意思
- 妡是什么意思
- 妢是什么意思
- 妢胡是什么意思
- 妣是什么意思
- 妣吉是什么意思
- 妣妓是什么意思
- 妣祖是什么意思
- 妣考是什么意思
- 妤是什么意思
- 妥是什么意思
- 妥不了是什么意思
- 妥了是什么意思
- 妥侑是什么意思
- 妥便是什么意思
- 妥倒是什么意思
- 妥儿直是什么意思
- 妥切是什么意思
- 妥则列是什么意思
- 妥协是什么意思
- 妥协企图是什么意思
- 妥协余地是什么意思
- 妥协关税法是什么意思
- 妥协和平是什么意思
- 妥协态度是什么意思
- 妥协性是什么意思
- 妥协精神是什么意思
- 妥协行为是什么意思
- 妥否是什么意思
- 妥吧是什么意思
- 妥呃是什么意思
- 妥呱之直是什么意思
- 妥商是什么意思
- 妥啦是什么意思
- 妥善是什么意思
- 妥善地处理后遗问题是什么意思
- 妥善处理是什么意思
- 妥善安置、各得其所是什么意思
- 妥善收藏是什么意思
- 妥善的谋划是什么意思
- 妥妥是什么意思
- 妥妥当当是什么意思
- 妥妥服行是什么意思
- 妥妥的是什么意思
- 妥妥贴贴是什么意思
- 妥娘是什么意思
- 妥宁是什么意思
- 妥安是什么意思
- 妥实是什么意思
- 妥布霉素是什么意思
- 妥帖是什么意思
- 妥帖恰当是什么意思
- 妥帖,合适妥当是什么意思
- 妥帖,有着落是什么意思
- 妥干是什么意思
- 妥当是什么意思
- 妥当侬是什么意思
- 妥当公平地处理是什么意思